Ácido confluéntico
| Ácido confluéntico | ||
|---|---|---|
| General | ||
| Fórmula estructural |
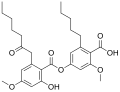 | |
| Fórmula molecular | ? | |
| Identificadores | ||
| Número CAS | 6009-12-7[1] | |
| ChEBI | 144140 | |
| PubChem | 99614 | |
| Propiedades físicas | ||
| Masa molar | 500,241018112 g/mol | |
El ácido confluentico es un compuesto orgánico perteneciente a la clase química conocida como depsidas. Actúa como un metabolito secundario en ciertos líquenes y desempeña un papel en la distinción de especies estrechamente relacionadas dentro del género Porpidia. En 1899, Friedrich Wilhelm Zopf aisló un compuesto de Lecidea confluens, al que inicialmente nombró confluentina y señaló que tenía un punto de fusión de 147-148 °C. Esta sustancia demostró la capacidad de tornar el papel de tornasol rojo y, al interactuar con álcali, se descompuso en dióxido de carbono y compuestos similares a fenoles. Zopf posteriormente revisó la fórmula química y el punto de fusión del compuesto. Siegfried Huneck lo renombró como ácido confluentínico en 1962, caracterizándolo como ópticamente inactivo, con reacciones de color distintivas y propiedades de solubilidad, y determinó su fórmula molecular como C28H36O8.
Los investigadores suelen identificar la presencia de ácido confluentico mediante métodos como la cromatografía en capa fina y la cromatografía líquida de alta resolución. Además, un método alternativo de detección visual implica examinar el talo o el apotecio (cuerpo fructífero) del liquen bajo un microscopio en una lámina tratada con hidróxido de potasio, lo que revela gotas de aceite indicativas de ácido confluentico. Varios análogos estructurales del ácido confluentico han sido aislados de una variedad de especies de líquenes.
Historia
En 1899, Friedrich Wilhelm Zopf informó haber aislado una sustancia de Lecidea confluens, a la que nombró confluentina, caracterizada por un punto de fusión de 147-148 °C (297-298 °F).[2] También encontró que esta sustancia tornaba el papel de tornasol rojo, reaccionaba con FeCl3 para producir un color marrón rojizo y se descomponía en dióxido de carbono, una sustancia volátil y un compuesto similar a fenol con un punto de fusión de 52 °C al interactuar con álcali. Zopf inicialmente propuso la fórmula C37H50O10 para este compuesto[2] antes de revisarla a C26H36O7, señalando el punto de fusión actualizado como 154 grados Celsius (309,2 °F).[3]
En su informe de 1962 sobre sus investigaciones químicas de la sustancia, el químico alemán Siegfried Huneck propuso nombrarla «ácido confluentínico» debido a la presencia del grupo funcional ácido carboxílico, alineándose con las convenciones de nomenclatura de otros productos de líquenes.[nota 1] Huneck describió la sustancia como ópticamente inactiva y señaló su baja solubilidad en éter de petróleo, acetato de etilo y acetona, pero encontró que era fácilmente soluble en éter, benceno y metanol. Observó las siguientes reacciones de color: marrón débil con solución de FeCl3 alcohólica, azul, verde y finalmente violeta con hidróxido de potasio y cloroformo al calentarse, naranja a naranja-rojo con benzidina tetrazotizada y gris-violeta con p-fenilendiamina; no se observó coloración con hidróxido de bario. Huneck utilizó análisis elemental y la determinación del peso molecular por titulación para establecer la fórmula molecular del ácido confluentínico como C28H36O8. La determinación de Zeisel para el análisis del grupo metoxi indicó dos grupos metoxilo por molécula.[3]
La propuesta de John Elix y Brian Ferguson para la síntesis total del ácido confluentico en 1978 marcó un avance significativo en la comprensión de esta sustancia de liquen, permitiendo a los científicos estudiar mejor y comprender la estructura y la actividad biológica del compuesto sin depender únicamente de la extracción natural. La síntesis comenzó con la condensación directa de ácidos carboxílicos aromáticos y fenoles adecuadamente sustituidos, utilizando diciclohexilcarbodiimida. Los precursores clave involucrados fueron ácido benzoicos especialmente preparados, con medidas protectoras para los grupos reactivos. El proceso incluyó pasos como bromación, alquilación y el uso estratégico de grupos protectores para las funcionalidades de fenol y carboxilo. La síntesis culminó con la eliminación de los grupos protectores y la hidrogenólisis sobre carbono paladizado para producir las depsidas deseadas, incluyendo el ácido confluentico.[5] En 1993, G. Fegie y colegas introdujeron un método estandarizado de cromatografía líquida de alto rendimiento que permitió la separación y detección de cientos de productos de líquenes, incluido el ácido confluentico.[6]
Propiedades
El ácido confluentico es un miembro de la clase de compuestos químicos llamados depsidas. Su nombre IUPAC es ácido 4-[2-hidroxi-4-metoxi-6-(2-oxoheptil)benzoil]oxi-2-metoxi-6-pentilbenzoico. Los máximos de absorbancia ultravioleta (λmax) tienen dos picos en 268 y 304 nm. En el espectro infrarrojo, los picos significativos indicativos del grupo funcional ácido carboxílico ocurren a 1700 cm−1 (estiramiento C=O en grupos carbonilo) y dentro del rango amplio de 2600 a 3100 cm−1 (estiramiento O-H). La banda ancha a 3100 se debe al enlace de hidrógeno, mientras que el pico a 3500 es la banda de estiramiento COOH.[3] La fórmula molecular del ácido confluentico es C28H36O8; tiene una masa molecular de 500,57 gramos por mol. En su forma purificada, existe como agujas cristalinas con un punto de fusión de 157 grados Celsius (314,6 °F).[7]
Ocurrencia
_Hertel_%2526_Knoph_271656.jpg)
El micobionte (socio fúngico) del liquen Lecidea tessellata ha demostrado producir ácido confluentico cuando se cultiva sin su socio algal fotobionte.[8] También se ha informado de ácido confluentico en cultivos de micobiontes de Parmelina carporrhizans.[9] El ácido confluentico es producido por casi todas las especies del género Immersaria, que suele estar acompañado por ácido 2'-O-metilmicrofilínico.[10] La ausencia de ácido confluentico distingue a Inoderma nipponicum de otras especies del género Inoderma, que típicamente contienen este químico.[11] El único carácter que distingue de manera fiable a Porpidia contraponenda y la morfológicamente similar Porpidia cinereoatra es su química secundaria: la primera contiene 2'-O-metilmicrofilinato y la última tiene ácido confluentico.[12] Un quimiosíndrome es un conjunto de compuestos relacionados biosintéticamente producidos por un liquen. El quimiosíndrome del ácido confluentico fue identificado en varios líquenes de la familia Lecideaceae; contiene ácido confluentico como el metabolito principal, y cantidades menores de ácido 2'-O-metilperlatólico, éter monometílico de olivetónida y ácido 2'-O-metilmicrofilínico.[13]
No solo limitado a hongos formadores de líquenes, también se ha informado de ácido confluentico en la planta brasileña Himatanthus sucuuba, destacando la distribución biológica más amplia del compuesto.[14]

Un estudio sobre Cryptothecia rubrocincta revela composiciones bioquímicas distintas en varias partes de su talo, sugiriendo roles especializados para los compuestos presentes. Específicamente, el ácido confluentico se encontró exclusivamente en manchas marrones localizadas dentro de las zonas roja y rosa del talo, junto con oxalato de calcio monohidrato. Esta distribución contrasta con otras áreas del talo, como la zona blanca que contiene solo oxalato de calcio dihidrato y la zona rojo oscuro con ácido chiodectónico, clorofila, beta-caroteno y oxalato de calcio dihidrato adicional en la subzona rosa. La presencia de ácido confluentico en áreas específicas sin beta-caroteno ni ácido chiodectónico —ambos conocidos protectores contra UV— sugiere que el ácido confluentico desempeña un papel diferente en la estrategia de supervivencia del liquen. Aunque la función exacta del ácido confluentico en estas manchas marrones localizadas no está clara, se indica que no es necesario para la protección contra la radiación. El estudio también destaca una transición dentro del liquen del oxalato de calcio dihidrato a la forma monohidrato más estable, asociada con el proceso de envejecimiento y posiblemente con las actividades metabólicas que involucran el ácido confluentico.[15]
Detección
Alan Fryday (1991) describió una técnica para la detección de ácido confluentico en muestras de líquenes. Este método implica colocar una sección del talo o del apotecio (cuerpo fructífero) del liquen en una lámina de microscopio, que luego se satura con una solución de hidróxido de potasio (KOH) al 10%. Cuando se examina bajo un microscopio compuesto a 40x de aumento, un distintivo «halo» de pequeñas gotas de aceite o burbujas que emanan de la sección de tejido indica la presencia de ácido confluentico.[16] Las gotas de aceite generadas durante este proceso de detección consisten en 4-O-metilolivetonida, un compuesto que es insoluble en solución de hidróxido de potasio. Esta sustancia se forma como resultado de la hidrólisis del ácido confluentico en presencia de hidróxido de potasio.[17] Esta prueba es particularmente útil para distinguir entre especies morfológicamente similares pero químicamente distintas dentro del género Porpidia, ayudando a una identificación y estudio precisos.[18]
Compuestos relacionados
La diversidad química dentro de los líquenes incluye una variedad de compuestos relacionados con el ácido confluentico, reflejando las complejas capacidades biosintéticas de estos organismos simbióticos y su importancia en la taxonomía y ecología de los líquenes. En 1987, Chicita Culberson y colegas informaron del uso de cromatografía líquida de alta resolución para aislar e identificar sustancias análogas de mayor contenido de carbono en la «serie confluentica», incluyendo ácido hiperconfluentico, ácido superconfluentico y ácido subconfluentico. Estas sustancias fueron aisladas del liquen Pseudobaeomyces pachycarpa.[19] La estructura del ácido subconfluentico (ácido 4-[2'-hidroxi-4'-metoxi-6'-(2"-oxopentil)benzoiloxi]-2-metoxi-6-pentilbenzoico) fue establecida posteriormente por síntesis.[20] El compuesto 4-O-demetilsuperconfluentico, estructuralmente similar al ácido confluentico, fue aislado de Stirtonia ramosa. Otro análogo, el ácido 2-O-metilconfluentico, fue identificado en Lecidea fuscoatra.[7]
Gowan (1989) sugirió una relación química y biosintética cercana entre el metil 2'-O-metilmicrofilinato y el ácido confluentico, señalando que las vías biosintéticas que conducen a estos compuestos difieren principalmente en la longitud del segmento acetil-polimalonilo. Esto significa que los dos compuestos se sintetizan a través de procesos similares, diferenciándose principalmente en el tamaño de una cadena específica dentro de la molécula. Además, hay solo una variación menor en sus patrones de metilación. Gowan sugirió además que el metil 2'-O-metilmicrofilinato probablemente se originó a partir de un antecesor que ya producía ácido confluentico.[13]
Notas
- ↑ El nombre «confluentina» fue usado posteriormente en 2003 para un prenilfenol natural aislado de especímenes del hongo formador de setas Albatrellus confluens.[4]
Referencias
- ↑ Número CAS
- ↑ a b Zopf, Wilhelm (1899). «Zur Kenntniss der Flechtenstoffe» [Sobre el conocimiento de las sustancias de líquenes]. Justus Liebigs Annalen der Chemie (en alemán) 306 (3): 282-321. doi:10.1002/jlac.18993060304.
- ↑ a b c Huneck, Siegfried (1962). «Über Flechteninhaltsstoffe, I. Konstitution der Confluentinsäure» [Sobre los constituyentes de líquenes, I. Constitución del ácido confluentínico]. Chemische Berichte (en alemán) 95 (2): 328-332. doi:10.1002/cber.19620950206.
- ↑ Hellwig, Veronika; Nopper, Reilinde; Mauler, Frank; Freitag, Joachim; Ji-Kai, Liu; Zhi-Hui, Ding; Stadler, Marc (2003). «Activities of prenylphenol derivatives from fruitbodies of Albatrellus spp. on the human and rat vanilloid receptor 1 (VR1) and characterisation of the novel natural product, confluentin» [Actividades de derivados de prenilfenol de cuerpos fructíferos de Albatrellus spp. en el receptor vaniloide 1 (VR1) humano y de rata y caracterización del nuevo producto natural, confluentina]. Archiv der Pharmazie 336 (2): 119-126. PMID 12761765. doi:10.1002/ardp.200390008.
- ↑ Elix, John; Ferguson, B.A. (1978). «Synthesis of the lichen depsides, olivetoric acid, confluentic acid and 4-O-methylolivetoric acid» [Síntesis de las depsidas de líquenes, ácido olivetórico, ácido confluentico y ácido 4-O-metilolivetórico]. Australian Journal of Chemistry 31 (5): 1041-1051. doi:10.1071/CH9781041.
- ↑ Feige, G.B.; Lumbsch, H.T.; Huneck, S.; Elix, J.A. (1993). «Identification of lichen substances by a standardized high-performance liquid chromatographic method» [Identificación de sustancias de líquenes mediante un método estandarizado de cromatografía líquida de alto rendimiento]. Journal of Chromatography A 646 (2): 417-427. doi:10.1016/0021-9673(93)83356-W.
- ↑ a b Huneck, Siegfried (1996). Identification of Lichen Substances [Identificación de sustancias de líquenes]. Berlin, Heidelberg: Springer Berlin Heidelberg. pp. 244-245. ISBN 978-3-642-85245-9. OCLC 851387266.
- ↑ Namada, N.; Tanahashi, T.; Goldsmith, S.; Nash III, T.H. (1997). «Induction of secondary products in isolated mycobionts from North American Lichens» [Inducción de productos secundarios en micobiontes aislados de líquenes norteamericanos]. Symbiosis 23: 219-224.
- ↑ Alors, David; Divakar, Pradeep Kumar; Calchera, Anjuli; Schmitt, Imke; Crespo, Ana; Molina, María Carmen (2023). «The temporal variation of secondary metabolites in the mycobiont culture and thallus of Parmelina carporrhizans and Parmelina quercina analyzed using high-performance liquid chromatography» [La variación temporal de metabolitos secundarios en el cultivo de micobiontes y el talo de Parmelina carporrhizans y Parmelina quercina analizados mediante cromatografía líquida de alta resolución]. Separations 10 (7): e399. doi:10.3390/separations10070399.
- ↑ Xie, Cong-Miao; Wang, Li-Song; Zhao, Zun-Tian; Zhang, Yan-Yun; Wang, Xin-Yu; Zhang, Lu-Lu (2022). «Revision of Immersaria and a new lecanorine genus in Lecideaceae (lichenised Ascomycota, Lecanoromycetes)» [Revisión de Immersaria y un nuevo género lecanorino en Lecideaceae (Ascomycota liquenizada, Lecanoromycetes)]. MycoKeys (87): 99-132. PMC 8863769. PMID 35210924. doi:10.3897/mycokeys.87.72614. Consultado el 17 de julio de 2025.
- ↑ Frisch, Andreas; Ohmura, Yoshihito; Ertz, Damien; Thor, Göran (2015). «Inoderma and related genera in Arthoniaceae with elevated white pruinose pycnidia or sporodochia» [Inoderma y géneros relacionados en Arthoniaceae con picnidios o esporodoquios pruinosos blancos elevados]. The Lichenologist 47 (4): 233-256. doi:10.1017/S0024282915000201.
- ↑ Fryday, Alan M. (2005). «The genus Porpidia in northern and western Europe, with special emphasis on collections from the British Isles» [El género Porpidia en el norte y oeste de Europa, con especial énfasis en colecciones de las Islas Británicas]. The Lichenologist 37 (1): 1-35. doi:10.1017/S0024282904014628.
- ↑ a b Gowan, Sharon P. (1989). «A character analysis of the secondary products of the Porpidiaceae (lichenized Ascomycotina)» [Análisis de los caracteres de los productos secundarios de la Porpidiaceae (Ascomycotina liquenizada)]. Systematic Botany 14 (1): 77-90. JSTOR 2419052. doi:10.2307/2419052.
- ↑ Endo, Yuichi; Hayashi, Hiroko; Sato, Toshitsugu; Maruno (M.Chin), Masao; Ohta, Tomihisa; Nozoe, Shigeo (1994). «Confluentic acid and 2'-O-methylperlatolic acid, monoamine oxidase B inhibitors in a Brazilian plant, Himatanthus sucuuba» [Ácido confluentico y ácido 2'-O-metilperlatólico, inhibidores de la monoamina oxidasa B en una planta brasileña, Himatanthus sucuuba]. Chemical and Pharmaceutical Bulletin 42 (6): 1198-1201. PMID 8069971. doi:10.1248/cpb.42.1198. Consultado el 17 de julio de 2025.
- ↑ a b Edwards, Howell G.M.; de Oliveira, Luiz F.C.; Seaward, Mark R.D. (2005). «FT-Raman spectroscopy of the Christmas wreath lichen, Cryptothecia rubrocincta (Ehrenb.:Fr.) Thor» [Espectroscopia FT-Raman del liquen de corona de Navidad, Cryptothecia rubrocincta (Ehrenb.:Fr.) Thor]. The Lichenologist 37 (2): 181-189. doi:10.1017/S0024282905014611.
- ↑ Fryday, Alan (1991). «A microscopic test for confluentic acid» [Una prueba microscópica para el ácido confluentico]. British Lichen Society Bulletin 70: 31. Consultado el 17 de julio de 2025.
- ↑ Fryday, Alan (1992). «The chemistry of the new confluentic acid test» [La química de la nueva prueba de ácido confluentico]. British Lichen Society Bulletin 71: 41. Consultado el 17 de julio de 2025.
- ↑ Orange, A.; James, P.W.; White, F.J. (2001). Microchemical Methods for the Identification of Lichens [Métodos microquímicos para la identificación de líquenes]. British Lichen Society. p. 13. ISBN 978-0-9540418-0-9.
- ↑ Culberson, Chicita F.; Culberson, William Louis; Gowan, Sharon; Johnson, Anita (1987). «New depsides from lichens: microchemical methodologies applied to the study of new natural products discovered in herbarium specimens» [Nuevas depsidas de líquenes: metodologías microquímicas aplicadas al estudio de nuevos productos naturales descubiertos en especímenes de herbario]. American Journal of Botany 74 (3): 403-414. doi:10.1002/j.1537-2197.1987.tb08622.x.
- ↑ Elix, J.A.; Wardlaw, J.H.; David, F. (1996). «The structure of subconfluentic acid, a depside from the lichen Lecidella cf. cyanosarca» [La estructura del ácido subconfluentico, una depsida del liquen Lecidella cf. cyanosarca]. Australian Journal of Chemistry 49 (1): 159-161. doi:10.1071/CH9960159.