Arsenoazúcares

Los arsenoazúcares son compuestos orgánicos de arsénico formados por 3 partes diferentes:[1]
- Un núcleo de 5-desoxipentosa;
- Un grupo arsinoilo (–AsR2(=O)), arsinotioilo (–AsR2(=S)) o arsonio (-As+R3) unido al carbono 5 del anillo. En este grupo, el arsénico puede ser trivalente o pentavalente, puede estar unido a un átomo de oxígeno (oxoarsenoazúcares), a un átomo de azufre (tioarsenoazúcares) y/o a múltiples grupos metilo (arsinoilo dimetilado si son 2 metilos o arsinoilo trimetilado si son 3);
- Una cadena unida al carbono 1 del anillo, que puede estar formada por grupos funcionales muy variados.
Los arsenoazúcares más comunes son los oxoarsenoazúcares dimetilados con arsénico pentavalente, y en particular los 4 principales son los arsenoazúcares de glicerol, fosfato, sulfato y sulfonato.[1]
Estos compuestos constituyen la forma predominante de arsénico en las algas, pero también están presentes en cantidades significativas en moluscos herbívoros y gasterópodos.[2] Las algas marinas contienen cantidades significativas de arsénico en diferentes formas químicas, que pueden ser tóxicas para los seres humanos y los animales y provocar diversos problemas de salud, incluido el cáncer. Si bien la toxicidad del arsénico es más conocida en su forma inorgánica, se sabe muy poco acerca de la seguridad del arsénico presente en compuestos orgánicos como los arsenoazúcares y, especialmente, los arsenolípidos de las algas marinas. Por lo tanto, es de suma importancia evaluar la toxicidad de los compuestos de arsénico de las algas marinas.[3]
Lista de arsenoazúcares
Aquí se enumera la mayoría de los arsenoazúcares descubiertos hasta la fecha, indicando el nombre común según la nomenclatura propuesta por Nischwitz y Pergantis,[4] el nombre completo y las referencias bibliográficas (del primer descubrimiento del compuesto o del nombre utilizado).
Oxoarsenoazúcares dimetilados
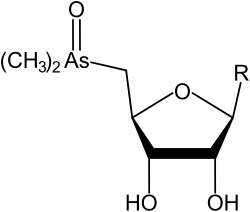
| R | Nombre común | Nombre completo (inglés) | Fórmula | Peso molecular (g/mol) | Abreviatura GC-MS | Ref. |
|---|---|---|---|---|---|---|
| Arsenoazúcar de glicerol (DMAsSugarGlycerol) | 2',3'-dihydroxypropyl 5-deoxy-5-(dimethylarsinoyl)-β-D-riboside | C10H21AsO7 | 328,194 | Oxo-arsenosugar-328 (AsSug 328) | [1][5] | |
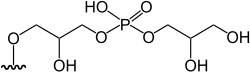
|
Arsenoazúcar fosfato (DMAsSugarPhosphate) | 3-‘Glycerophosphoryl’-2- hydroxy-1-[5-deoxy-5-(dimethylarsinoyl)-β-ribofuranosyloxy]propane | C13H28AsO12P | 482,253 | Oxo-arsenosugar-482 (AsSug 482) | [1][5] |
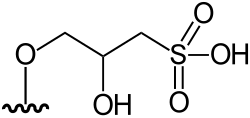
|
Arsenoazúcar sulfonato (DMAsSugarSulfonate) | 3-[5′-Deoxy-5′- (dimethylarsinoyl)- β-D-ribosyloxy]-2- hydroxypropane-1-sulfonic acid | C10H21AsO9S | 392,259 | Oxo-arsenosugar-392 (AsSug 392) | [1][5] |
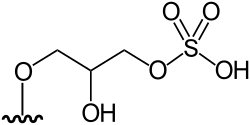
|
Arsenoazúcar sulfato (DMAsSugarSulfate) | (2S)-3-[5-deoxy-5-(dimethylarsinoyl)-β-D-ribofuranosyloxy]-2-hydroxypropyl hydrogen sulphate | C10H21AsO10S | 408,258 | Oxo-arsenosugar-408 (AsSug 408) | [1][5] |
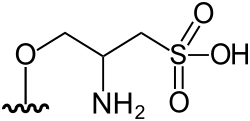
|
Arsenoazúcar aminosulfonato (DMAsSugarAminoSulfonate) | 2-amino-3-[5-deoxy-5-(dimethylarsinoyl)-β-D-ribofuranosyloxy]propene-1-sulphonic acid | C10H22AsO8SN | 391,274 | Oxo-arsenosugar-391 (AsSug 391) | [1][6] |
| Arsenoazúcar (DMAsSugar) | 5-dimethylarsinoyl-β-ribofuranose | C7H15AsO5 | 254,115 | Oxo-arsenosugar-254 (AsSug 254) | [1][7] | |
| Metil arsenoazúcar (DMAsSugarMethyl) | methyl 5-deoxy-5-(dimethylarsinoyl)-β-D-riboside | C8H17AsO5 | 268,142 | [1][8] | ||
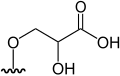
|
DMAsSugarCarboxyl | (2R)-3-{[5-Deoxy-5-(dimethylarsoryl)-β-D-ribofuranosyl]oxy}-2-hydroxypropanoic acid | C10H19AsO8 | 342,176 | [1][9] | |
|
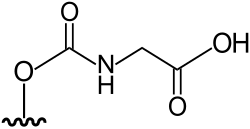
DMAsSugarCarbamate | N-(5'-deoxy-5'-dimethylarsinoyl-β-D-ribosyloxycarbonyl) glycine | C10H18AsNO8 | 355,176 | [1][9] | |
|
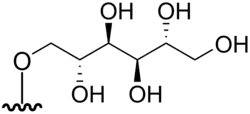
DMAsSugarMannitol | 1-O-[5'-deoxy-5'-(dimethylarsinoyl)-β-D-ribosyl]mannitol | C13H27AsO10 | 418,271 | [1][8] | |
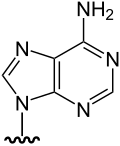
|
DMAsSugarAdenine | 5'-deoxy-5'-dimethylarsinoyl-adenosine (DDMAA) | C12H18AsN5O4 | 371,23 | [4][9] | |
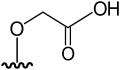
|
DMAsSugarCarboxyl-2 | 2-[5-deoxy-5-(dimethylarsinoyl)-β-ribofuranosyloxy]-acetic acid | C9H17AsO7 | 312,151 | [7][10] | |
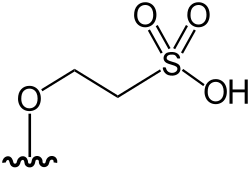
|
DMAsSugarSulfonate-2 | 2-[5-deoxy-5-(dimethylarsinoyl)-β-ribofuranosyloxy]-ethan sulfonic acid | C9H19AsO8S | 362,233 | [10] | |
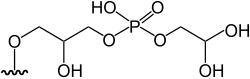
|
3-[5'-deoxy-5'-(dimethylarsinoyl)-β-ribofuranosyloxy]-2-hydroxypropyl 2,di-hydroxyethyl phosphate | [7] | ||||
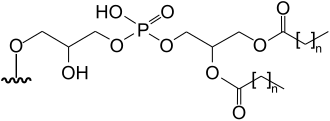
|
[8][11] | |||||
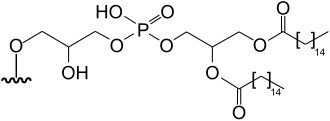
|
dipalmitoylglycerophospho-2-hydroxypropyl-5-deoxy-5-(dimethylarsinoyl)-β-ribofuranoside | [11][12] |
Tioarsenoazúcares dimetilados
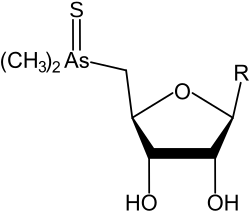
| R | Nombre común (inglés) | Fórmula | Peso molecular (g/mol) | Abreviatura GC-MS | Ref. |
|---|---|---|---|---|---|
| DMThioAsSugarGlycerol | C10H21AsO6S | 344,261 | Thio-arsenosugar-328 (thio-AsSug328) | [4] | |

|
DMThioAsSugarPhosphate | C13H28AsO11PS | 498,32 | Thio-arsenosugar-482 (thio-AsSug482) | [4] |

|
DMThioAsSugarSulfonate | C10H20AsO8S2 | 407,318 | Thio-arsenosugar-392 (thio-AsSug392) | [4][13] |

|
DMThioAsSugarSulfate | C10H20AsO9S2 | 423,317 | Thio-arsenosugar-408 (thio-AsSug408) | [4][13] |
| Tioarsenoazúcar (DMThioAsSugar) | C7H15AsO4S | 270.181 | Thio-arsenosugar-254 (thio-AsSug254) |
Arsenoazúcares trimetilados
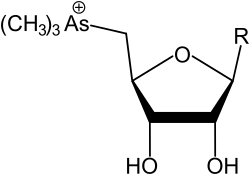
| R | Nombre común (inglés) | Nombre completo (inglés) | Ref. |
|---|---|---|---|
| TMAsSugarGlycerol | 3-[5'-deoxy-5'-(trimethylarsonio)-β-ribofuranosyloxy]-2-hydroxypropylene glycol | [4][14] | |

|
TMAsSugarSulfate | 3'-[5-deoxy-5-(trimethylarsonio)-β-D-ribosyloxy]-2'-hydroxypropyl sulphate | [4][8] |

|
TMAsSugarPhosphate | 3-[5'-deoxy-5'-(trimethylarsonio)-β-ribofuranosyloxy]-2-hydroxypropyl 2,3-hydroxypropyl phosphate | [4] |

|
TMAsSugarSulfonate | 3-[5'-deoxy-5'-(trimethylarsonio)-β-ribofuranosyloxy]-2-hydroxypropanesulfonic acid | [4] |

|
TMAsSugarAminoSulfonate | [15] | |
| TMAsSugarHydroxy | 5-trimethylarsonio-β-ribofuranose | [1][7] | |
| TMAsSugarMethoxy | methyl-(5-deoxy-5-trimethylarsonio)-β-ribofuranoside | [10] |
Otros arsenoazúcares
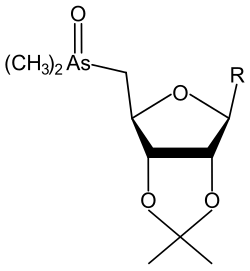
| R | Nombre completo (inglés) | Ref. |
|---|---|---|
| methyl 5-deoxy-5-(dimethylarsinoyl)-2,3-O-isopropylidene-β-D-riboside | [8] | |

|
2',3'-isopropylidenedioxypropyl 5-deoxy-5-dimethyl-arsinoyl-2,3-O-isopropylidene-β-D-riboside | [9] |
| 2',3'-dihydroxypropyl 5-deoxy-5-dimethylarsinoyl-2,3-O-isopropylidene-β-D-riboside | [9] | |
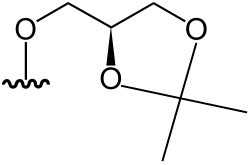
|
2',3'-isopropylidenedioxypropyl 5-deoxy-5-dimethylarsinoyl-2,3-O-isopropylidene-β-D-riboside | [9] |
-sugars_with_isopropylidene.svg.png)
| R | Nombre completo (inglés) | Ref. |
|---|---|---|

|
[12][16] | |
| dimethyl (methyl-2,3-O-isopropylidene-5-deoxy-β-D-ribofuranose-5-yl) arsine | [17] |
Finalmente, existen arsenoazúcares particulares que no entran en ninguna de las categorías mostradas anteriormente.
| Imagen | Nombre completo (inglés) | Ref. |
|---|---|---|
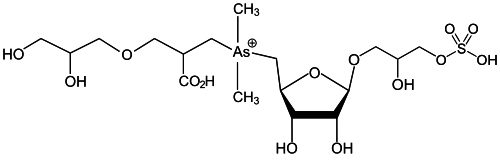
|
[8] | |
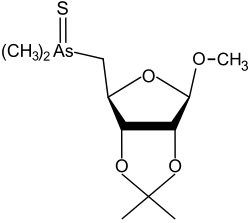
|
methyl-2,3-O-isopropylidene-5-deoxy-5-dimethyl-thioarsinoyl-β-D-ribofuranoside | [17] |
.svg.png)
|
5-dimethylarsinoyl-β-ribofuranose |
Presencia en la naturaleza

Los arsenoazúcares están presentes principalmente en las algas (alrededor del 78% de la fracción de arsénico) y constituyen una fracción significativa del arsénico también en los moluscos marinos y gasterópodos (alrededor del 23%); y viceversa, están presentes en concentraciones muy bajas en el pescado y el arroz.[2] También se han encontrado en organismos terrestres (líquenes, hongos, lombrices y algunas especies vegetales), pero en general los organismos marinos contienen mayor cantidad de estos compuestos que los terrestres o de agua dulce.[1]
Su concentración varía desde trazas (por ejemplo todos los trimetilarsenoazúcares) hasta µg/g;[1] en general su distribución y concentración en las algas marinas depende fuertemente de la clase taxonómica: el arsenoazúcar glicerol y el sulfonato, por ejemplo, eran aislados por primera vez en 1981 del alga parda Ecklonia radiata,[18] mientras que en el alga parda Hizikia fusiforme se ha determinado que el arsenoazúcar sulfato es el principal compuesto de arsénico.[6] Finalmente, en las algas rojas (Rhodophyta) y verdes (Chlorophyta) los arsenoazúcares más presentes son el glicerol y el fosfato.[19]
Se cree que los arsenoazúcares se sintetizan en organismos marinos a partir de arsénico inorgánico (tomado del agua de mar) mediante procesos de alquilación oxidativa como mecanismo de desintoxicación:[20][21] esto parece ser cierto sólo en presencia de un bajo contenido de arsénico, mientras que en concentraciones elevadas también se forman monometilarsonato (MA) y dimetilarsinato (DMA), y en concentraciones muy elevadas (100 µg As l−1) se produce una acumulación de arsénico tóxico debido al cese de los procesos de desintoxicación.[22] También puede darse el caso de que un paso intermedio entre el arsénico inorgánico y los arsenoazúcares sea la formación de arsenolípidos.[21][23] Finalmente, cuando las algas mueren, los arsenoazúcares se convierten en arseniato y DMA.[24]
Propiedades químicas
Las moléculas de los arsenoazúcares generalmente tienen un carácter catiónico y polar debido al grupo (CH3)2As=O, y por esta razón son solubles en agua (a excepción del derivado dipalmitoílo del fosfato de arsenoazúcar[11]).[1] Sin embargo, sus propiedades ácidas dependen casi exclusivamente de la aglicona,[1] y para los 4 arsenoazúcares principales el orden de acidez es el siguiente: sulfato > sulfonato > fosfato > glicerol (que no contiene un grupo ácido).[25] Se caracterizan por una estabilidad química relativamente baja (inferior a la de la arsenobetaína) y su degradación se produce preferentemente en un ambiente ácido o gástrico (probablemente favorecido por la actividad enzimática o microbiana).
Los tioarsenoazúcares son menos polares y menos estables[26] que los oxoarsenoazúcares.
Metabolismo y toxicidad
En cuanto al estudio del metabolismo de estos compuestos en humanos, el principal problema consiste en la gran variabilidad del comportamiento en diferentes individuos.[2][21] El estudio de la toxicidad de los arsenoazúcares es de gran interés debido al elevado consumo alimentario de algas, especialmente en los países asiáticos:[27] en Japón, por ejemplo, el consumo de algas puede suponer una ingesta de alrededor de 1 mg de arsénico al día[28] (las algas contienen una cantidad de arsénico equivalente a unos 100 mg por kg de peso seco[27]), mientras que la dosis diaria tolerada de arsénico establecida por las directrices de la Organización Mundial de la Salud es de 0,002 mg por kg de peso corporal (por tanto, unos 0,15 mg para una persona que pesa 75 kg).[29] Sin embargo, hasta la fecha no existe información definitiva sobre la toxicidad de estos compuestos[1], por lo que la Autoridad Europea de Seguridad Alimentaria no los considera individualmente.[30] El arsenoazúcar glicerol parece no tener citotoxicidad,[31][32] mientras que los arsenoazúcares con arsénico trivalente generalmente muestran una actividad citotóxica mayor que los arsenoazúcares con arsénico pentavalente,[27] pero aún no ha sido posible sacar una conclusión general sobre toda la clase de compuestos.[2]
En general, no se han detectado cantidades significativas de arsenoazúcares en la orina humana tras la ingestión de algas[33] o muestras sintéticas de estos compuestos, por lo que se sabe que se metabolizan. Los metabolitos identificados son principalmente DMA, pero también MA y DMAE (dimetilarsinoiletanol),[33] a través de transformaciones metabólicas desconocidas a partir de dimetiloxoarsenosazúcares (algunos pasos han sido propuestos por Feldmann en 2011[2]), y en el proceso también pueden ocurrir reducciones a especies de arsénico trivalentes o tiolaciones del oxígeno del grupo arseno. Se sabe que el DMA tiene una mayor toxicidad que los arsenoazúcares,[2] e incluso las formas reducidas y tioladas son potencialmente más tóxicas ya que pueden unirse a los grupos sulfhidrilo de proteínas y péptidos.[34] Además, los principales metabolitos (DMA, MA y DMAE) coinciden con los derivados del arsénico inorgánico, teniendo por tanto un efecto similar; Por esta razón, los arsenosazúcares se consideran especies potencialmente tóxicas[2][21] (aunque, como afirma Francesconi, «los datos limitados sobre la toxicidad de los arsenosazúcares hasta la fecha indican una baja toxicidad»[21]).
También se han realizado estudios sobre los posibles efectos cancerígenos de estas sustancias analizando la orina de ovejas con una dieta basada en algas (animales que tienen un metabolismo para estos compuestos similar al de los humanos, ya que se han identificado los mismos metabolitos encontrados en la orina humana): aunque no se han encontrado problemas de salud particulares en estos individuos, su vida relativamente corta (4-6 años) no permite evaluar el riesgo de cáncer debido a los arsenoazúcares.[2]
Referencias
- ↑ a b c d e f g h i j k l m n ñ o p q Niegel, C.; Matysik, F.-M. (2010). «Analytical methods for the determination of arsenosugars- A review of recents trends and developments». Analytica Chimica Acta 657 (2): 83-99. doi:10.1016/j.aca.2009.10.041.
- ↑ a b c d e f g h Feldmann, J.; Krupp, E.M. (2011). «Critical review or scientific opinion paper: Arsenosugars — a class of benign arsenic species or justification for developing partly speciated arsenic fractionation in foodstuffs?». Analytical and Bioanalytical Chemistry 399 (5): 1735-1741. doi:10.1007/s00216-010-4303-6.
- ↑ «Overcoming barriers in estimating toxicity of arsenic species in seaweed». CORDIS - Resultados de investigaciones de la UE.
- ↑ a b c d e f g h i j Nischwitz, V.; Pergantis, S. A. (2005). «Liquid Chromatography Online with Selected Reaction Monitoring Electrospray Mass Spectrometry for the Determination of Organoarsenic Species in Crude Extracts of Marine Reference Materials». Analytical Chemistry 77 (17): 5551-5563. doi:10.1021/ac050445b.
- ↑ a b c d McSheehy, S.; Marcinek, M., Chassaigne, H., Szpunar, J. (2000). «Identification of dimethylarsinoyl-riboside derivatives in seaweed by pneumatically assisted electrospray tandem mass spectrometry». Analytica Chimica Acta 410 (1-2): 71-84. doi:10.1016/S0003-2670(00)00706-6.
- ↑ a b Edmonds, J. S.; Morita, M., Shibata, Y., (1987). «Isolation and identification of arsenic-containing ribofuranosides and inorganic arsenic from japanese edible seaweed Hizikia fusiforme». Journal of the Chemical Society, Perkin Transactions 1: 577-580. doi:10.1039/P19870000577.
- ↑ a b c d McSheehy, S.; Szpunar, J., Lobinski, R., Haldys, V., Tortajada, J., Edmonds, J. S. (2002). «Characterization of Arsenic Species in Kidney of the Clam Tridacna derasa by Multidimensional Liquid Chromatography-ICPMS and Electrospray Time-of-Flight Tandem Mass Spectrometry». Analytica Chimica Acta 74 (10): 2370-2378. doi:10.1021/ac011136y.
- ↑ a b c d e f Francesconi, K. A.; Edmonds, J. S., Stick, R. V., Skelton, B. W., White, A. H. (1991). «Arsenic-containing ribosides from the brown alga Sargassum lacerifolium: X-ray molecular structure of 2-amino-3-[5'-deoxy-5'-(dimethylarsinoyl)-ribosyloxy]propane-1-sulphonic acid». Journal of the Chemical Society, Perkin Transactions 1 (11): 2707-2716. doi:10.1039/P19910002707.
- ↑ a b c d e f Francesconi, K. A.; Edmonds, J. S., Stick, R. V. (1992). «Arsenic compounds from the kidney of the giant clam Tridacna maxima: isolation and identification of an arsenic-containing nucleoside». Journal of the Chemical Society, Perkin Transactions 1 (11): 1349-1357. doi:10.1039/P19920001349.
- ↑ a b c Nischwitz, V.; Pergantis, S. A. (2007). «Mapping of arsenic species and identification of a novel arsenosugar in giant clams Tridacna maxima and Tridacna derasa using advanced mass spectrometric techniques». Environmental Chemistry 4 (3): 187-196. doi:10.1071/EN07009.
- ↑ a b c Morita, M.; Shibata, Y. (1988). «Isolation and identification of arseno-lipid from a brown alga, Undaria pinnatifida (Wakame)». Chemosphere 17 (6): 1147-1152. doi:10.1016/0045-6535(88)90180-4.
- ↑ a b Edmonds, J. S.; Francesconi, K. A., Stick, R. V. (1993). «Arsenic compounds from marine organisms». Natural Product Reports 10 (4): 421-428. doi:10.1039/NP9931000421.
- ↑ a b Kahn, M.; Raml, R., Schmeisser, E., Vallant, B., Francesconi, K. A., Goessler, W. (1993). «Two Novel Thio-Arsenosugars in Scallops Identified with HPLC–ICPMS and HPLC–ESMS». Environmental Chemistry 2 (3): 171-176. doi:10.1071/EN05045.
- ↑ Francesconi, K. A.; Goessler, W., Panutrakul, S., Irgolic, K. J. (1998). «A novel arsenic containing riboside (arsenosugar) in three species of gastropod». Science of the Total Environment 221 (2-3): 139-148. doi:10.1016/S0048-9697(98)00272-1.
- ↑ McSheehy, S.; Pohl, P., Vélez, D., Szpunar, J. (2002). «Multidimensional liquid chromatography with parallel ICP MS and electrospray MS/MS detection as a tool for the characterization of arsenic species in algae». Analytical and Bioanalytical Chemistry 372 (3): 457-466. doi:10.1007/s00216-001-1182-x.
- ↑ Mcadam, D. P.; Perera, A. M. A., Stick, R. V. (1987). «The Synthesis of (R)-2',3'-Dihydroxypropyl 5-Deoxy-5-Dimethylarsinyl-β-D-Riboside, a Naturally Occurring Arsenic-Containing Carbohydrate». Australian Journal of Chemistry 40 (11): 1901-1908. doi:10.1071/CH9871901.
- ↑ a b Gyepes, A.; Schäffer, R., Bajor, G., Woller, Á., Fodor, P. (2008). «Synthesis and chromatographic study of methyl-2,3-O-isopropylidene-5-dimethyl-arsinoyl-β-D-ribofuranoside and methyl-2,3-O-isopropylidene-5-deoxy-5-dimethyl-thioarsinoyl-β-D-ribofuranoside». Polyhedron 27 (12): 2655-2661. doi:10.1016/j.poly.2008.04.049.
- ↑ Edmonds, J. S.; Francesconi, K. A. (1981). «Arseno-sugars from brown kelp (Ecklonia radiata) as intermediates in cycling of arsenic in a marine ecosystem». Nature 289 (5798): 602-604. doi:10.1038/289602a0.
- ↑ Francesconi, K. A.; Edmonds, J. S. (1996). «Arsenic and marine organisms». Advances in Inorganic Chemistry 44: 147-189. doi:10.1016/S0898-8838(08)60130-0.
- ↑ Edmonds, J. S.; Francesconi, K. A. (1983). «Arsenic-containing ribofuranosides: isolation from brown kelp Ecklonia radiata and nuclear magnetic resonance spectra». Journal of the Chemical Society, Perkin Transactions 1 (0): 2375-2382. doi:10.1039/P19830002375.
- ↑ a b c d e Francesconi, K. A. (2010). «Arsenic species in seafood: Origin and human health implications». Pure and Applied Chemistry 82 (2): 373-381. doi:10.1351/PAC-CON-09-07-01.
- ↑ Geiszinger, A.; Goessler, W., Pedersen, S. N., Francesconi, K. A. (2001). «Arsenic biotransformation by the brown macroalga Fucus serratus». Environmental Toxicology and Chemistry 20 (10): 2255-2262. doi:10.1002/etc.5620201018.
- ↑ Cooney, R. V.; Mumma, R. O., Benson., A. A. (1978). «Arsoniumphospholipid in algae». Proceedings of the National Academy of Sciences of the United States of America (PNAS) 75 (9): 4262-4264. doi:10.1073/pnas.75.9.4262.
- ↑
- ↑ Madsen, A. D.; Goessler, W., Pedersen, S. N., Francesconi, K. A. (2000). «Characterization of an algal extract by HPLC-ICP-MS and LC-electrospray MS for use in arsenosugar speciation studies». Journal of Analytical Atomic Spectrometry 15 (6): 657-662. doi:10.1039/B001418O.
- ↑ Raml, R.; Francesconi, K. A., Goessler, W. (2006). «Improved chromatographic separation of thio-arsenic compounds by reversed-phase high performance liquid chromatography-inductively coupled plasma mass spectrometry». Journal of Chromatography A 1128 (1-2): 164-170. doi:10.1016/j.chroma.2006.06.061.
- ↑ a b c Andrewes, A., DeMarini, D. M., Funasaka, K., Wallace, K., Lai, V. W. M., Sun, H., Cullen, W. R., Kitchin, K. T., (2004). «Do Arsenosugars Pose a Risk to Human Health? The Comparative Toxicities of a Trivalent and Pentavalent Arsenosugar». Environmental Science & Technology 38 (15): 4140-4148. doi:10.1021/es035440f.
- ↑ «Use of a food composition database to estimate daily dietary intake of nutrient or trace elements in Japan, with reference to its limitation». Food Additives and Contaminants, Taylor & Francis 13 (7): 775-786. 1996. doi:10.1080/02652039609374465.
- ↑ «Evaluation of certain food additives and contaminants, EFSA, 1989». WHO, Technical Report Series 776.
- ↑ «Scientific Opinion on Arsenic in Food». EFSA Journal 7 (10): 1351. 1996. doi:10.2903/j.efsa.2009.1351.
- ↑ Oya-Ohta, Y., Kaise, T., Ochi, T. «Induction of chromosomal aberrations in cultured human fibroblasts by inorganic and organic arsenic compounds and the different roles of glutathione in such induction, Elsevier, 1996». Mutation Research/Fundamental and Molecular Mechanisms of Mutagenesis 357 (1-2): 123-129. doi:10.1016/0027-5107(96)00092-9.
- ↑ Sakurai, T. (2002). «Review: Biological effects of organic arsenic compounds in seafood». Applied Organometallic Chemistry 16 (8): 401-405. doi:10.1002/aoc.325.
- ↑ a b van Hulle, M., Zhang, C., Schotte, B., Mees, L., Vanhaecke, F., Vanholder, R., Zhang, X. R., Cornelis, R. (2006). «Identification of some arsenic species in human urine and blood after ingestion of Chinese seaweed Laminaria». Journal of Analytical Atomic Spectrometry 19 (1): 58-64. doi:10.1039/B307457A.
- ↑ Raab, A., Wright, S., Jaspars, M., Meharg, A., Feldmann, J. (2007). «Pentavalent Arsenic Can Bind to Biomolecules». Angewandte Chemie International Edition 46 (15): 2594-2597. doi:10.1002/anie.200604805.