Carga alostática
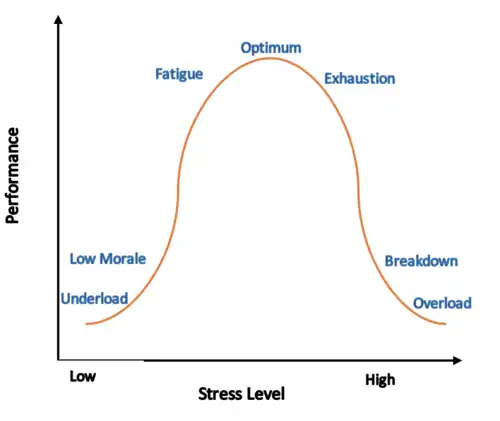
La carga alostática, (o peso alostático) (en inglés Allostatic load) es "el desgaste por uso" del cuerpo, que se acumula cuando un individuo está expuesto a estrés repetido o crónico.[1] El término fue acuñado por Bruce McEwen y Eliot Stellar en 1993.[2] Representa las consecuencias fisiológicas de la exposición crónica a una respuesta ya sea neuronal o bien neuroendocrina fluctuante o aumentada que resulta de un estrés crónico repetido o prolongado.
Modelo regulatorio
La carga alostática es parte de «el modelo regulador de la alostasis», donde la regulación predictiva o estabilización de las sensaciones internas en respuesta a estímulos, se le asigna al cerebro.[3] La alostasis se basa en la regulación de la homeostasis en el cuerpo para disminuir las consecuencias fisiológicas en el organismo.[4][5] La regulación predictiva se refiere a la capacidad del cerebro para anticipar las necesidades y prepararse para satisfacerlas antes de que surjan.[3]
Parte de una regulación eficiente es la reducción de la incertidumbre. Los seres humanos son naturalmente reacios a las sorpresas; por eso, se esfuerzan constantemente por reducir la incertidumbre de los resultados futuros, y la alostasis lo permite al anticipar las necesidades y planificar cómo satisfacerlas con anticipación.[6] Pero hacer esto requiere una cantidad considerable de energía cerebral y, si no se logra resolver la incertidumbre, la situación puede volverse crónica y dar como resultado la acumulación de carga alostática.[6]
El concepto de carga alostática establece que "las respuestas neuroendocrinas, cardiovasculares, neuroenergéticas y emocionales se activan de forma persistente, de modo que las turbulencias del flujo sanguíneo en las arterias coronarias y cerebrales, la presión arterial alta, la aterogénesis, la disfunción cognitiva y el estado de ánimo deprimido aceleran la progresión de la enfermedad". Todos los efectos duraderos de las respuestas al estrés continuamente activadas se denominan carga alostática (Allostatic load). La carga alostática puede provocar alteraciones permanentes en la arquitectura cerebral y la fisiopatología sistémica.[6][7]
La carga alostática minimiza la capacidad de un organismo para afrontar y reducir la incertidumbre en el futuro.
Tipos
McEwen y Wingfield proponen dos tipos de carga alostática con diferentes etiologías y consecuencias distintas:
La carga alostática tipo 1 ocurre cuando la demanda de energía excede la oferta, lo que resulta en la activación de la etapa de emergencia del historial de vida. Esto sirve para alejar al animal de las etapas normales de su historia de vida y llevarlo a un modo de supervivencia que disminuye la carga alostática y recuperar el equilibrio energético positivo. El ciclo de vida normal puede reanudarse cuando la perturbación haya pasado. Las situaciones típicas que terminan en alostasis tipo 1 son la inanición, la hibernación y la enfermedad crítica. Cabe destacar que las consecuencias potencialmente mortales de una enfermedad crítica pueden ser tanto causas como consecuencias de la carga alostática.[8][9][10]
La carga alostática de tipo 2 resulta de un consumo de energía suficiente o incluso excesivo acompañado de conflicto social u otros tipos de disfunción social. Esto último es lo que ocurre en la sociedad humana y en ciertas situaciones que afectan a los animales en cautiverio. En todos los casos, la secreción de glucocorticosteroides y la actividad de otros mediadores de la alostasis, como el sistema nervioso autónomo, los neurotransmisores del SNC y las citocinas inflamatorias, aumentan y disminuyen con la carga alostática. Si la carga alostática es crónicamente alta, pueden desarrollarse patologías. La sobrecarga alostática tipo 2 no desencadena una respuesta de escape y sólo puede contrarrestarse mediante el aprendizaje y cambios en la estructura social.[11]
Si bien ambos tipos de carga alostática se asocian con una mayor liberación de cortisol y catecolaminas, afectan de manera diferencial la homeostasis tiroidea: las concentraciones de la hormona tiroidea triyodotironina disminuyen en la alostasis tipo 1, pero aumentan en la alostasis tipo 2. Esto puede ser resultado de una interacción de la carga alostática tipo 2 con el punto de ajuste de la función tiroidea.[12]
Situaciones especiales pueden implicar una combinación de carga alostática tanto de tipo 1 como de tipo 2. Los ejemplos incluyen el ejercicio agotador y la adaptación a las condiciones antárticas.[13]
Medición
La carga alostática generalmente se mide a través de un índice compuesto de indicadores de tensión acumulada en varios órganos y tejidos, principalmente biomarcadores asociados con los sistemas neuroendocrino, cardiovascular, inmunológico y metabólico.[14]
Los índices de carga alostática varían según los estudios y con frecuencia se evalúan de manera diferente, utilizando distintos biomarcadores y distintos métodos para ensamblar un índice de carga alostática. La carga alostática no es exclusiva de los humanos y puede utilizarse para evaluar los efectos fisiológicos del estrés crónico o frecuente también en primates no humanos.[14] La medida de carga alostática acumulada en ratas (rat cumulative allostatic load measure: rCALM) es un marcador de carga alostática en roedores.[15]
En el sistema neuro-endocrino, el aumento o los niveles repetidos de estrés resultan en niveles cerebrales elevados de la hormona CRH, que desencadena la activación del escalón endócrino siguiente el eje hipotalámico-hipofisario-adrenal (HHS) con secreción hipofisaria de hormona ACTH con efecto en el siguiente escalón la suprarrenal.[16]
El HHS es el sistema central de respuesta al estrés responsable de la modificación de las respuestas inflamatorias en todo el cuerpo.
Los niveles de estrés prolongados pueden provocar una disminución de los niveles de cortisol por la mañana y un aumento de los niveles por la tarde, lo que genera una mayor producción diaria de cortisol que a largo plazo aumenta los niveles de azúcar en la sangre.
En el sistema nervioso, las anomalías estructurales y funcionales son resultado del estrés crónico prolongado. El aumento de los niveles de estrés provoca un acortamiento de las dendritas en las neuronas. Por lo tanto, el acortamiento de las dendritas provoca una disminución de la atención.[5] El estrés crónico también provoca una mayor respuesta del sistema nervioso al miedo a lo no aprendido y al condicionamiento del miedo.[17]
En el sistema inmune, el aumento de los niveles de estrés crónico resulta en la elevación de la inflamación. El aumento de los niveles de inflamación es causado por la activación continua del sistema nervioso simpático.[18] El deterioro de la inmunidad adquirida mediada por células también es un factor que afecta al sistema inmunológico debido al estrés crónico.[5]
El paquete R pscore proporciona funciones para el cálculo simplificado y automatizado y la evaluación estadística de los componentes fisiológicos de la puntuación de síntomas del síndrome metabólico (MSSS) y la carga alostática.
Relación con la alostasis y la homeostasis
La mayor contribución a la carga alostática es el efecto del estrés en el cerebro. La alostasis es el sistema que ayuda a lograr la homeostasis.[19] La homeostasis es la regulación de los procesos fisiológicos, mediante los cuales los sistemas del cuerpo responden al estado del cuerpo y al entorno externo.[19] La relación entre la alostasis y la carga alostática es el concepto de anticipación. La anticipación puede impulsar la producción de los mediadores. Los ejemplos de mediadores incluyen las neurohormonas y el cortisol. El exceso de estos mediadores provocará un aumento de la carga alostática, lo que contribuirá a la ansiedad y la anticipación.[19]
La alostasis y la carga alostática están relacionadas con la dimensión de las conductas que promueven y dañan la salud, como por ejemplo el tabaquismo, el consumo de alcohol, la mala alimentación y la inactividad física.
Tres procesos fisiológicos provocan un aumento de la carga alostática:
- Estrés frecuente: la magnitud y frecuencia de la respuesta al estrés es lo que determina el nivel de carga alostática que afecta al cuerpo.
- Apagado fallido: incapacidad del cuerpo para apagarse cuando el estrés se acelera y los niveles en el cuerpo exceden los niveles normales, por ejemplo, presión arterial elevada.
- Respuesta inadecuada: la incapacidad de los sistemas del cuerpo para responder a un desafío, por ejemplo, niveles excesivos de inflamación debido a respuestas endógenas de glucocorticoides inadecuadas.
La importancia de la homeostasis es regular los niveles de estrés que encuentra el cuerpo para reducir la carga alostática.
La alostasis disfuncional hace que la carga alostática aumente, lo que puede, con el tiempo, provocar una enfermedad, a veces con una descompensación del problema controlada por la alostasis. Los efectos de la carga alostática se pueden medir en el cuerpo. Al tabularse en forma de índices de carga alostática utilizando métodos analíticos sofisticados, da una indicación de los efectos acumulativos a lo largo de la vida de todos los tipos de estrés en el cuerpo.[20]
Causas de la carga alostática
La carga alostática tipo 1 representa la respuesta adaptativa a una falta absoluta de energía, glutatión y varios macronutrientes. También incluye respuestas predictivas (por ejemplo, hibernación, infección y depresión).[cita requerida]
La carga alostática de tipo 2 resulta de un desajuste esperado entre la demanda y la oferta de energía. Se desencadena por factores estresantes psicosociales, como un nivel socioeconómico bajo, eventos importantes de la vida y factores estresantes ambientales.[20] Esta asociación explica el mayor riesgo de enfermedades cardiovasculares y enfermedades crónicas como la obesidad, la diabetes, la hipertensión y los trastornos psicóticos en sujetos expuestos a traumas psicosociales, desventajas sociales y discriminación.[3][21] Los mecanismos socioculturales tienden a aumentar esta relación al perpetuar la disparidad incluso en la calidad de la atención sanitaria, que tiende a ser inferior en los estratos de población socialmente desfavorecidos.[22][23]
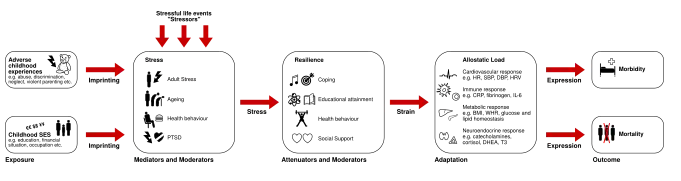
Cuando la acumulación de experiencias estresantes conduce a una exposición crónica a fluctuaciones en las respuestas neuronales o neuroendocrinas que superan la capacidad de afrontamiento del individuo, el resultado se considera una carga alostática.[24][25] Los factores que provocan carga alostática incluyen los siguientes: excitación fisiológica continua debido al estrés crónico, mecanismos de afrontamiento inadecuados, respuesta al estrés que continúa después de la finalización de un factor estresante y una respuesta alostática insuficiente a un factor estresante.[26] Una respuesta alostática típica es iniciada por un factor estresante y continúa mientras dura dicho factor, hasta que se desactiva cuando este termina. La carga alostática es la acumulación de factores estresantes y respuestas desadaptativas que pueden resultar en un estado extremo, donde la respuesta al estrés no termina.[27]
Se ha demostrado que el impacto a largo plazo de la adversidad infantil (por ejemplo, abuso, negligencia) tiene efectos duraderos, incluido el mayor riesgo de carga alostática en la edad adulta.[28] Independientemente del tipo, se ha encontrado una asociación entre la discriminación y la carga alostática en la edad adulta.[29] Las conductas de riesgo para la salud, como los malos hábitos alimentarios y la obesidad, la inactividad física, el consumo de sustancias y la falta de sueño también se consideran factores de riesgo de carga alostática.[30]
La activación prolongada del eje HPA, así como del sistema nervioso autónomo, puede tener consecuencias negativas en la salud biológica. De manera similar, cuando la remodelación estructural (por ejemplo, los procesos celulares y moleculares desde el núcleo de una célula hasta la superficie de una célula) de la arquitectura neuronal, que es un resultado clave del estrés, continúa más allá de la terminación de un factor estresante, el cuerpo ya no mantiene un estado de homeostasis y la respuesta prolongada al estrés tiene implicaciones negativas.[27] El cuerpo humano se regula a sí mismo para mantener un estado de homeostasis mediante el uso de mecanismos alostáticos, pero cuando hay respuestas de estrés prolongadas que continúan más allá de la duración de la terminación del factor estresante, esto conduce al fallo de estos sistemas.[30][27]
Implicaciones de la carga alostática en la salud
El aumento de la carga alostática constituye un riesgo importante para la salud. Varios estudios documentaron una fuerte asociación entre la carga alostática y la incidencia de enfermedad cardíaca coronaria,[31] con marcadores sustitutos de salud cardiovascular[32][33][34][35] y con puntos finales duros, incluida la mortalidad por causa específica y por todas las causas.[36][37] Los mediadores que conectan la carga alostática con la morbilidad y la mortalidad incluyen la función del sistema nervioso autónomo,[38] las citocinas y las hormonas de estrés (por ejemplo, catecolaminas,[39][40] al cortisol,[41][42][43][44] y las hormonas tiroideas).[45] Las implicaciones biológicas de la carga alostática incluyen impactos tanto en el funcionamiento cognitivo como en el físico, siendo la corteza prefrontal, el hipocampo y la amígdala regiones que pueden verse específicamente afectadas por ella.[46]
Reducción del riesgo
Para reducir y controlar la carga alostática elevada, una persona debe prestar atención a los factores estructurales (p. ej., el entorno social, el acceso a la atención médica) y conductuales (p. ej., la dieta, la salud física y el tabaquismo, que pueden conducir a enfermedades crónicas).[47]
El nivel socioeconómico bajo afecta la carga alostática y, por lo tanto, centrarse en las causas del bajo nivel socioeconómico puede reducir los niveles de carga alostática. La reducción de la polarización social, la privación material y las exigencias psicológicas sobre la salud ayuda a gestionar la carga alostática.[48] El apoyo de la comunidad y del entorno social permite gestionar una carga alostática elevada.[48] Además, un estilo de vida saludable que abarque una amplia gama de cambios en el estilo de vida, incluida una alimentación saludable y ejercicio físico regular, puede reducir la carga alostática.[49] La ayuda financiera del gobierno permite a las personas ganar control y mejorar su salud psicológica.[48] Mejorar las desigualdades en salud disminuye los niveles de estrés y mejora la salud al reducir la alta carga alostática en el cuerpo.[48]
Las intervenciones pueden incluir fomentar la calidad y cantidad del sueño, el apoyo social, la autoestima y el bienestar, mejorar la dieta, evitar el consumo de alcohol o drogas y participar en actividad física.[50] Proporcionar entornos más limpios y seguros y el incentivo hacia una educación superior reducirán las posibilidades de estrés y mejorarán significativamente la salud mental, reduciendo así la aparición de una alta carga alostática.[50]
La carga alostática difiere según el sexo, la edad y el estatus social de un individuo. Se podrían implementar factores protectores en distintos momentos de la vida de un individuo para reducir el estrés y, a largo plazo, eliminar la aparición de carga alostática.[4] Los factores protectores incluyen el vínculo parental, la educación, el apoyo social, lugares de trabajo saludables, un sentido de significado hacia la vida y las decisiones que se toman,[50] y sentimientos positivos en general.[4]
Véase también
Referencias
- ↑ Health Psychology: A textbook (tercera edición). Open University Press - McGraw-Hill Education. 2004. pp. 259. ISBN 978-0335214716.
- ↑ McEwen B.S. ; Stellar E. (Septiembre de 1993). «Stress and the individual. Mechanisms leading to disease». Archives of Internal Medicine 153 (18): 2093-2101. PMID 8379800. doi:10.1001/archinte.153.18.2093.
- ↑ a b c Sterling P. (Abril de 2012). «Allostasis: a model of predictive regulation». Physiology & Behavior 106 (1): 5-15. PMID 21684297. doi:10.1016/j.physbeh.2011.06.004.
- ↑ a b c Schenk H.M.; Jeronimus B.F.; van der Krieke L.; Bos E.H.; de Jonge P.; Rosmalen J.G. (2017). «Associations of Positive Affect and Negative Affect With Allostatic Load: A Lifelines Cohort Study». Psychosomatic Medicine 80 (2): 160-166. PMID 29215457. doi:10.1097/PSY.0000000000000546. Consultado el 7 de mayo de 2025.
- ↑ a b c Danese A.; McEwen B.S. (Abril de 2012). «Adverse childhood experiences, allostasis, allostatic load, and age-related disease». Physiology & Behavior 106 (1): 29-39. PMID 21888923. doi:10.1016/j.physbeh.2011.08.019.
- ↑ a b c Peters A.; McEwen B.S.; Friston K. (Septiembre de 2017). «Uncertainty and stress: Why it causes diseases and how it is mastered by the brain». Progress in Neurobiology 156: 164-188. PMID 28576664. S2CID 286501. doi:10.1016/j.pneurobio.2017.05.004. Consultado el 7 de mayo de 2025.
- ↑ Dolan, Eric W. (20 de octubre de 2022). «New study uncovers a troubling interaction between depression and allostatic load». PsyPost (en inglés estadounidense). Consultado el 7 de mayo de 2025.
- ↑ Brame AL, Singer M (Octubre de 2010). «Stressing the obvious? An allostatic look at critical illness». Critical Care Medicine 38 (10 Suppl): S600-S607. PMID 21164403. S2CID 39889109. doi:10.1097/CCM.0b013e3181f23e92.
- ↑ Cuesta JM, Singer M (Diciembre de 2012). «The stress response and critical illness: a review». Critical Care Medicine 40 (12): 3283-3289. PMID 22975887. S2CID 7064946. doi:10.1097/CCM.0b013e31826567eb.
- ↑ Chatzitomaris A, Hoermann R, Midgley JE, Hering S, Urban A, Dietrich B, Abood A, Klein HH, Dietrich JW (2017). «Thyroid Allostasis-Adaptive Responses of Thyrotropic Feedback Control to Conditions of Strain, Stress, and Developmental Programming». Frontiers in Endocrinology 8: 163. PMC 5517413. PMID 28775711. doi:10.3389/fendo.2017.00163.
- ↑ McEwen BS, Wingfield JC (Enero de 2003). «The concept of allostasis in biology and biomedicine». Hormones and Behavior 43 (1): 2-15. PMID 12614627. S2CID 11329342. doi:10.1016/S0018-506X(02)00024-7.
- ↑ Dietrich JW, Hoermann R, Midgley JE, Bergen F, Müller P (26 de octubre de 2020). «The Two Faces of Janus: Why Thyrotropin as a Cardiovascular Risk Factor May Be an Ambiguous Target». Frontiers in Endocrinology 11: 542710. PMC 7649136. PMID 33193077. doi:10.3389/fendo.2020.542710. Consultado el 7 de mayo de 2025.
- ↑ Spinelli, E; Werner Junior, J (13 de abril de 2022). «Human adaptative behavior to Antarctic conditions: A review of physiological aspects.». WIREs Mechanisms of Disease 14 (5): e1556. PMID 35419979. doi:10.1002/wsbm.1556.
- ↑ a b Edes AN, Crews DE (Enero de 2017). «Allostatic load and biological anthropology». American Journal of Physical Anthropology 162 (Suppl 63): 44-70. PMID 28105719. doi:10.1002/ajpa.23146.
- ↑ McCreary, JK; Erickson, ZT (January 2019). «The rat cumulative allostatic load measure (rCALM): a new translational assessment of the burden of stress.». Environmental Epigenetics 5 (1): dvz005. PMC 6500369. PMID 31065381. doi:10.1093/eep/dvz005. Consultado el 7 de mayo de 2025. Parámetro desconocido
|apellidos3 E3=ignorado (ayuda) - ↑ Danese A. ; McEwen BS. (Abril de 2012). «Adverse childhood experiences, allostasis, allostatic load, and age-related disease». Physiology & Behavior 106 (1): 29-39. PMID 21888923. doi:10.1016/j.physbeh.2011.08.019.
- ↑ Hoffman, Ann N.; Lorson, Nickolaus G.; Sanabria, Federico; Foster Olive, M.; Conrad, Cheryl D. (Julio de 2014). «Chronic stress disrupts fear extinction and enhances amygdala and hippocampal Fos expression in an animal model of post-traumatic stress disorder». Neurobiology of Learning and Memory (en inglés) 112: 139-147. PMC 4051860. PMID 24508064. doi:10.1016/j.nlm.2014.01.018. Consultado el 7 de mayo de 2025.
- ↑ Danese A. ; McEwen B.S. (Abril de 2012). «Adverse childhood experiences, allostasis, allostatic load, and age-related disease». Physiology & Behavior 106 (1): 29-39. PMID 21888923. doi:10.1016/j.physbeh.2011.08.019.
- ↑ a b c McEwen BS (Mayo de 1998). «Stress, adaptation, and disease. Allostasis and allostatic load». Annals of the New York Academy of Sciences 840 (1): 33-44. Bibcode:1998NYASA.840...33M. PMID 9629234. S2CID 20043016. doi:10.1111/j.1749-6632.1998.tb09546.x.
- ↑ a b McEwen BS (Febrero de 2000). «Allostasis and allostatic load: implications for neuropsychopharmacology». Neuropsychopharmacology 22 (2): 108-124. PMID 10649824. doi:10.1016/S0893-133X(99)00129-3.
- ↑ Guidi J, Lucente M, Sonino N, Fava GA (2021). «Allostatic Load and Its Impact on Health: A Systematic Review». Psychotherapy and Psychosomatics 90 (1): 11-27. PMID 32799204. doi:10.1159/000510696.
- ↑ Falkentoft AC, Andersen J, Malik ME, Selmer C, Gæde PH, Staehr PB, Hlatky MA, Fosbøl E, Køber L, Torp-Pedersen C, Gislason GH, Gerds TA, Schou M, Bruun NE, Ruwald AC (March 2022). «Impact of socioeconomic position on initiation of SGLT-2 inhibitors or GLP-1 receptor agonists in patients with type 2 diabetes - a Danish nationwide observational study». The Lancet Regional Health. Europe 14: 100308. PMC 8802041. PMID 35146474. doi:10.1016/j.lanepe.2022.100308. Consultado el 7 de mayo de 2025.
- ↑ Nauck MA, Dietrich JW (Marzo de 2022). «Understanding the restrictions in the prescription and use of potentially beneficial diabetes medications associated with low socio-economic status». The Lancet Regional Health. Europe 14: 100318. PMC 8819377. PMID 35146476. doi:10.1016/j.lanepe.2022.100318. Consultado el 7 de mayo de 2025.
- ↑ Fava, Giovanni A.; Cosci, Fiammetta; Sonino, Nicoletta (2017). «Current Psychosomatic Practice». Psychotherapy and Psychosomatics (en inglés) 86 (1): 13-30. ISSN 0033-3190. PMID 27884006. doi:10.1159/000448856. Consultado el 7 de mayo de 2025.
- ↑ Guidi, Jenny; Lucente, Marcella; Sonino, Nicoletta; Fava, Giovanni A. (2021). «Allostatic Load and Its Impact on Health: A Systematic Review». Psychotherapy and Psychosomatics (en inglés) 90 (1): 11-27. ISSN 0033-3190. PMID 32799204. doi:10.1159/000510696. Consultado el 7 de mayo de 2025.
- ↑ Guidi, Jenny; Lucente, Marcella; Sonino, Nicoletta; Fava, Giovanni A. (2021). «Allostatic Load and Its Impact on Health: A Systematic Review». Psychotherapy and Psychosomatics (en inglés) 90 (1): 11-27. ISSN 0033-3190. PMID 32799204. doi:10.1159/000510696.
- ↑ a b c Fava, Giovanni A.; McEwen, Bruce S.; Guidi, Jenny; Gostoli, Sara; Offidani, Emanuela; Sonino, Nicoletta (Octubre de 2019). «Clinical characterization of allostatic overload». Psychoneuroendocrinology (en inglés) 108: 94-101. PMID 31252304. doi:10.1016/j.psyneuen.2019.05.028. Consultado el 7 de mayo de 2025.
- ↑ Widom, Cathy Spatz; Horan, Jacqueline; Brzustowicz, Linda (Septiembre de 2015). «Childhood maltreatment predicts allostatic load in adulthood». Child Abuse & Neglect (en inglés) 47: 59-69. PMC 4539293. PMID 25700779. doi:10.1016/j.chiabu.2015.01.016. Consultado el 7 de mayo de 2025.
- ↑ Miller, Hailey N.; LaFave, Sarah; Marineau, Lea; Stephens, Janna; Thorpe, Roland J. (Julio de 2021). «The impact of discrimination on allostatic load in adults: An integrative review of literature». Journal of Psychosomatic Research (en inglés) 146: 110434. PMC 8172431. PMID 33810863. doi:10.1016/j.jpsychores.2021.110434. Consultado el 7 de mayo de 2025.
- ↑ a b Suvarna, Beena; Suvarna, Aditya; Phillips, Riana; Juster, Robert-Paul; McDermott, Brett; Sarnyai, Zoltan (Enero de 2020). «Health risk behaviours and allostatic load: A systematic review». Neuroscience & Biobehavioral Reviews (en inglés) 108: 694-711. PMID 31846655. doi:10.1016/j.neubiorev.2019.12.020. Consultado el 7 de mayo de 2025.
- ↑ Gillespie SL, Anderson CM, Zhao S, Tan Y, Kline D, Brock G, Odei J, O'Brien E, Sims M, Lazarus SA, Hood DB, Williams KP, Joseph JJ (Noviembre de 2019). «Allostatic load in the association of depressive symptoms with incident coronary heart disease: The Jackson Heart Study». Psychoneuroendocrinology 109: 104369. PMC 7232849. PMID 31307010. doi:10.1016/j.psyneuen.2019.06.020. Consultado el 7 de mayo de 2025.
- ↑ Veronesi G, Cavicchiolo M, Ferrario MM (Deciembre de 2019). «Allostatic load as a mediator of the association between psychosocial risk factors and cardiovascular diseases. Recent evidence and indications for prevention». Giornale Italiano di Medicina del Lavoro ed Ergonomia 41 (4): 333-336. PMID 32126604.
- ↑ =Viljoen M, Claassen N (Junio de 2017). «Allostatic load and heart rate variability as health risk indicators». African Health Sciences 17 (2): 428-435. PMC 5637028. PMID 29062338. doi:10.4314/ahs.v17i2.17. Consultado el 7 de mayo de 2025.
- ↑ Magnusson Hanson LL, Rod NH, Vahtera J, Virtanen M, Ferrie J, Shipley M, Kivimäki M, Westerlund H (Agosto de 2020). «Job insecurity and risk of coronary heart disease: Mediation analyses of health behaviors, sleep problems, physiological and psychological factors». Psychoneuroendocrinology 118: 104706. PMID 32460194. doi:10.1016/j.psyneuen.2020.104706.
- ↑ Milad E. ; Bogg T. (Noviembre de 2020). «Personality Traits, Coping, Health-related Behaviors, and Cumulative Physiological Health in a National Sample: 10 Year Prospective Effects of Conscientiousness via Perceptions of Activity on Allostatic Load». Annals of Behavioral Medicine 54 (11): 880-892. PMC 7646150. PMID 32359064. doi:10.1093/abm/kaaa024. Consultado el 7 de mayo de 2025.
- ↑ Borrell L.N. ; Rodríguez-Álvarez E. ; Dallo F.J. (2020). «Racial/ethnic inequities in the associations of allostatic load with all-cause and cardiovascular-specific mortality risk in U.S. adults». PLOS ONE 15 (2): e0228336. Bibcode:2020PLoSO..1528336B. PMC 7018050. PMID 32053626. doi:10.1371/journal.pone.0228336. Consultado el 7 de mayo de 2025.
- ↑ Robertson T. ; Beveridge G. ; Bromley C. (2017). «Allostatic load as a predictor of all-cause and cause-specific mortality in the general population: Evidence from the Scottish Health Survey». PLOS ONE 12 (8): e0183297. Bibcode:2017PLoSO..1283297R. PMC 5559080. PMID 28813505. doi:10.1371/journal.pone.0183297. Consultado el 7 de mayo de 2025.
- ↑ Goldstein DS (Agosto de 2020). «The extended autonomic system, dyshomeostasis, and COVID-19». Clinical Autonomic Research 30 (4): 299-315. PMC 7374073. PMID 32700055. doi:10.1007/s10286-020-00714-0. Consultado el 7 de mayo de 2025.
- ↑ Brindley DN, Rolland Y (Noviembre de 1989). «Possible connections between stress, diabetes, obesity, hypertension and altered lipoprotein metabolism that may result in atherosclerosis». Clinical Science 77 (5): 453-461. PMID 2684477. doi:10.1042/cs0770453.
- ↑ Rigney T (Septiembre de 2010). «Allostatic load and delirium in the hospitalized older adult». Nursing Research 59 (5): 322-330. PMID 20671582. doi:10.1097/NNR.0b013e3181ec156b.
- ↑ Skinner ML, Shirtcliff EA, Haggerty KP, Coe CL, Catalano RF (Noviembre de 2011). «Allostasis model facilitates understanding race differences in the diurnal cortisol rhythm». Development and Psychopathology 23 (4): 1167-1186. PMC 3583352. PMID 22018088. doi:10.1017/S095457941100054X. Consultado el 7 de mayo de 2025.
- ↑ Adam EK, Heissel JA, Zeiders KH, Richeson JA, Ross EC, Ehrlich KB, Levy DJ, Kemeny M, Brodish AB, Malanchuk O, Peck SC, Fuller-Rowell TE, Eccles JS (Deciembre de 2015). «Developmental histories of perceived racial discrimination and diurnal cortisol profiles in adulthood: A 20-year prospective study». Psychoneuroendocrinology 62: 279-291. PMC 4739843. PMID 26352481. doi:10.1016/j.psyneuen.2015.08.018. Consultado el 7 de mayo de 2025.
- ↑ Price JL, Frazier IR, Lewis B, Walker R, Javors MA, Nixon SJ, Adinoff B (Febrero de 2019). «Differences in pituitary-adrenal reactivity in Black and White men with and without alcohol use disorder». Psychoneuroendocrinology 100: 180-189. PMC 6333532. PMID 30347319. doi:10.1016/j.psyneuen.2018.10.004. Consultado el 7 de mayo de 2025.
- ↑ Casavant SG, Cong X, Fitch RH, Moore J, Rosenkrantz T, Starkweather A (Marzo de 2019). «Allostatic Load and Biomarkers of Stress in the Preterm Infant: An Integrative Review». Biological Research for Nursing 21 (2): 210-223. PMID 30654634. doi:10.1177/1099800418824415.
- ↑ Aweimer A, El-Battrawy I, Akin I, Borggrefe M, Mügge A, Patsalis PC, Urban A, Kummer M, Vasileva S, Stachon A, Hering S, Dietrich JW (Mayo de 2021). «Abnormal thyroid function is common in takotsubo syndrome and depends on two distinct mechanisms: results of a multicentre observational study». Journal of Internal Medicine 289 (5): 675-687. PMID 33179374. doi:10.1111/joim.13189.
- ↑ Fava, Giovanni A.; Cosci, Fiammetta; Sonino, Nicoletta (2017). «Current Psychosomatic Practice». Psychotherapy and Psychosomatics (en inglés) 86 (1): 13-30. ISSN 0033-3190. PMID 27884006. doi:10.1159/000448856.
- ↑ Schenk HM, Jeronimus BF, van der Krieke L, Bos EH, de Jonge P, Rosmalen JG (2017). «Associations of Positive Affect and Negative Affect With Allostatic Load: A Lifelines Cohort Study». Psychosomatic Medicine 80 (2): 160-166. PMID 29215457. doi:10.1097/PSY.0000000000000546.
- ↑ a b c d Kristenson M, Eriksen HR, Sluiter JK, Starke D, Ursin H (Abril de 2004). «Psychobiological mechanisms of socioeconomic differences in health». Social Science & Medicine 58 (8): 1511-1522. PMID 14759694. doi:10.1016/s0277-9536(03)00353-8.
- ↑ Tan M, Mamun A, Kitzman H, Dodgen L (18 de abril de 2019). «Longitudinal Changes in Allostatic Load during a Randomized Church-based, Lifestyle Intervention in African American Women». Ethnicity & Disease 29 (2): 297-308. PMC 6478040. PMID 31057315. doi:10.18865/ed.29.2.297.
- ↑ a b c Juster RP, McEwen BS, Lupien SJ (Septiembre de 2010). «Allostatic load biomarkers of chronic stress and impact on health and cognition». Neuroscience and Biobehavioral Reviews 35 (1): 2-16. PMID 19822172. doi:10.1016/j.neubiorev.2009.10.002.