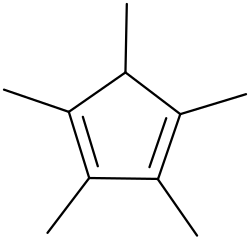
Pentametilciclopentadieno
| Pentametilciclopentadieno | ||
|---|---|---|
 | ||
 | ||
| Nombre IUPAC | ||
| 1,2,3,4,5-Pentametilciclopenta-1,3-dieno | ||
| General | ||
| Fórmula molecular | C10H16 | |
| Identificadores | ||
| Número CAS | 4045-44-7[1] | |
| ChemSpider | 70069 | |
| PubChem | 77667 | |
| UNII | DSE3MRZ77C | |
| Propiedades físicas | ||
| Apariencia | Líquido incoloro | |
| Densidad | 839,5 kg/m³; 0,8395 g/cm³ | |
| Masa molar | 136,238 g/mol | |
| Peligrosidad | ||
| SGA |
 | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
El 1,2,3,4,5-pentametilciclopentadieno es un dieno cíclico con la fórmulaC
5(CH
3)
5H, a menudo escrito como C
5Me
5H, donde Me es CH
3[2] Es un líquido incoloro.
El 1,2,3,4,5-pentametilciclopentadieno es el precursor del ligando 1,2,3,4,5-pentametilciclopentadienilo, que a menudo se denota Cp* (C
5Me
5) y se lee como "C P estrella", la "estrella" significa los cinco grupos metilo que irradian desde el núcleo del ligando. Por tanto, la fórmula del 1,2,3,4,5-pentametilciclopentadieno también se escribe Cp*H. A diferencia de los derivados de ciclopentadieno menos sustituidos, el Cp*H no es propenso a la dimerización.
Síntesis
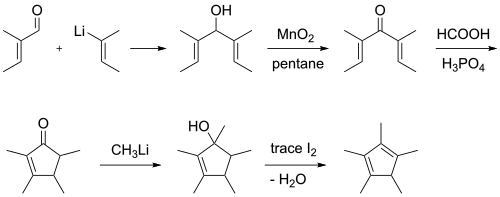
El pentametilciclopentadieno se encuentra disponible comercialmente. Se preparó por primera vez a partir de trans-2-metil-2-butenal y 2-butenillitio, a través de la 2,3,4,5-tetrametilciclopent-2-enona, con una reacción de ciclización de Nazarov como paso clave.[3]
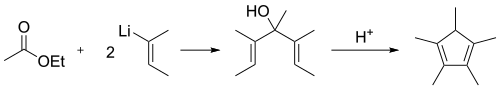
Alternativamente, el 2-butenil-litio se agrega al acetato de etilo seguido de una deshidrociclización catalizada por ácido:[4][5]
Muestra de pentametilciclopentadieno en ampolla.
Derivados organometálicos
| complejos metálicos Cp* | |
|---|---|
| Cp*2Fe | amarillo |
| Cp*TiCl3 | rojo |
| [Cp*Fe(CO)2]2 | rojo violeta |
| [Cp*RhCl2]2 | rojo |
| [Cp*IrCl2]2 | naranja |
| Cp*Re(CO)3 | incoloro |
| Cp*Mo(CO)2CH3 | naranja |
El Cp*H es un precursor de los compuestos organometálicos que contienen el anión C
5Me−
5 como ligando, comúnmente denominado Cp*−.[6]
Algunas reacciones representativas que conducen a dichos complejos de Cp*–metal son las siguientes:[7]
Desprotonación con n-butil-litio :
- Cp*H + C4H9Li → Cp *Li + C4H10
Síntesis de tricloruro de (pentametilciclopentadienil)titanio:
- Cp* Li + TiCl4 → Cp*TiCl3 + LiCl
Síntesis del dímero de dicarbonilo de (pentametilciclopentadienil)hierro a partir de pentacarbonilo de hierro:
- 2 Cp*H + 2 Fe(CO)5 ]] → [ η 5-Cp*Fe(CO)2]2 + H2 + 6 CO
Algunos complejos Cp* se preparan mediante transferencia de sililo:
- Cp*Li + Me3 SiCl → Cp*SiMe3 + LiCl
- Cp*SiMe3 + TiCl4 → Cp*TiCl3 + Me3SiCl
Una ruta ahora obsoleta para obtener complejos Cp* implica el uso de hexametilbenceno Dewar. Este método se utilizó tradicionalmente para la preparación de los dímeros con puente de cloro [Cp*IrCl2]2 y [Cp*RhCl2]2, pero se ha descontinuado con la mayor disponibilidad comercial de Cp*H. Estas síntesis se basan en una transposición inducida por haluro de hidrógeno del hexametilbenceno Dewar[8][9] a un pentametilciclopentadieno sustituido antes de la reacción con el hidrato de cloruro de iridio (III)[10] o cloruro de rodio (III).[11]
Comparación con otros ligandos Cp
3C5H3.png)
Los complejos de pentametilciclopentadienilo difieren en varios aspectos de los derivados de ciclopentadienilo (Cp) más comunes. Al ser más rico en electrones, el Cp* − es un donante más fuerte y la disociación, como el deslizamiento del anillo, es más difícil con Cp* que con Cp.[12] El ligando fluorado, (trifluorometil)tetrametilciclopentadienilo, C5Me4CF3, combina las propiedades de Cp y Cp*: posee la masa estérica de Cp* pero tiene propiedades electrónicas similares a Cp, siendo la donación de electrones de los grupos metilo "cancelada" por la naturaleza aceptora de electrones del sustituyente trifluorometilo.[13] Su volumen estérico estabiliza complejos con ligandos frágiles. Su volumen también atenúa las interacciones intermoleculares, disminuyendo la tendencia a formar estructuras poliméricas. Sus complejos también tienden a ser más solubles en disolventes no polares. El grupo metilo en los complejos Cp* puede sufrir una activación C–H dando lugar a " complejos tuck-in ". Se sabe que los ligandos de ciclopentadienilo voluminosos tienen una carga estérica mucho mayor que el Cp*.
Véase también
- ciclopentadieno
- Metilciclopentadieno
Referencias
- ↑ Número CAS
- ↑ Elschenbroich, C.; Salzer, A. (1989). Organometallics: A Concise Introduction. VCH. p. 47. ISBN 9783527278183.
- ↑ De Vries, L. (1960). «Preparation of 1,2,3,4,5-Pentamethyl-cyclopentadiene, 1,2,3,4,5,5-Hexamethyl-cyclopentadiene, and 1,2,3,4,5-Pentamethyl-cyclopentadienylcarbinol». J. Org. Chem. 25 (10): 1838. doi:10.1021/jo01080a623.
- ↑ "1,2,3,4,5-Pentamethylcyclopentadiene". Org. Synth..
- ↑ Fendrick, C. M.; Schertz, L. D.; Mintz, E. A.; Marks, T. J. (1992). «Large-Scale Synthesis of 1,2,3,4,5-Penta-Methylcyclopentadiene». Inorganic Syntheses 29. pp. 193-198. ISBN 978-0-470-13260-9. doi:10.1002/9780470132609.ch47.
- ↑ Yamamoto, A. (1986). Organotransition Metal Chemistry: Fundamental Concepts and Applications. Wiley-Interscience. p. 105. ISBN 9780471891710.
- ↑ King, R. B.; Bisnette, M. B. (1967). «Organometallic chemistry of the transition metals XXI. Some π-pentamethylcyclopentadienyl derivatives of various transition metals». J. Organomet. Chem. 8 (2): 287-297. doi:10.1016/S0022-328X(00)91042-8.
- ↑ Paquette, L. A.; Krow, G. R. (1968). «Electrophilic Additions to Hexamethyldewarbenzene». Tetrahedron Lett. 9 (17): 2139-2142. doi:10.1016/S0040-4039(00)89761-0.
- ↑ Criegee, R.; Gruner, H. (1968). «Acid-catalyzed Rearrangements of Hexamethyl-prismane and Hexamethyl-Dewar-benzene». Angewandte Chemie 7 (6): 467-468. doi:10.1002/anie.196804672.
- ↑ Kang, J. W.; Mosley, K.; Maitlis, P. M. (1968). «Mechanisms of Reactions of Dewar Hexamethylbenzene with Rhodium and Iridium Chlorides». Chem. Commun. (21): 1304-1305. doi:10.1039/C19680001304.
- ↑ Kang, J. W.; Maitlis, P. M. (1968). «Conversion of Dewar Hexamethylbenzene to Pentamethylcyclopentadienylrhodium(III) Chloride». J. Am. Chem. Soc. 90 (12): 3259-3261. Bibcode:1968JAChS..90.3259K. doi:10.1021/ja01014a063.
- ↑ Kuwabara, Takuya; Tezuka, Ryogen; Ishikawa, Mikiya; Yamazaki, Takuya; Kodama, Shintaro; Ishii, Youichi (25 de junio de 2018). «Ring Slippage and Dissociation of Pentamethylcyclopentadienyl Ligand in an (η5-Cp*)Ir Complex with a κ3-O, C, O Tridentate Calix[4]arene Ligand under Mild Conditions». Organometallics (en inglés) 37 (12): 1829-1832. ISSN 0276-7333. doi:10.1021/acs.organomet.8b00257.
- ↑ Gassman, Paul G.; Mickelson, John W.; Sowa, John R. (1 de agosto de 1992). «1,2,3,4-Tetramethyl-5-(trifluoromethyl)cyclopentadienide: a unique ligand with the steric properties of pentamethylcyclopentadienide and the electronic properties of cyclopentadienide». Journal of the American Chemical Society 114 (17): 6942-6944. Bibcode:1992JAChS.114.6942G. ISSN 0002-7863. doi:10.1021/ja00043a065.
![Synthesis of the iridium(III) dimer [Cp*IrCl2]2 using hexamethyl Dewar benzene](./C5Me5Ir2Cl2viaMe6DewarBen.png)