Síndrome de Beck-Fahrner
| Síndrome de Beck-Fahrner | ||
|---|---|---|
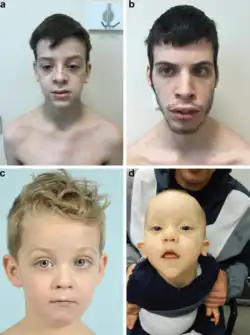 Los rasgos faciales suelen incluir una cara alargada con frente ancha, boca abierta, cejas arqueadas y orejas prominentes. | ||
| Especialidad | Genética médica, Pediatría | |
| Síntomas | Trastorno del desarrollo neurológico, Trastorno mental, Enfermedad neurológica y característica dismórfica | |
| Inicio habitual | Desde el nacimiento | |
| Duración | Toda la vida | |
| Tipos | Mutación de novo, Dominancia (genética) | |
| Causas | Mutaciones del gen TET3 | |
| Diagnóstico | Diagnóstico molecular, Examen genético | |
| Tratamiento | Tratamiento sintomático | |
| Sinónimos | ||
| BEFAHRS, deficiencia de TET3 | ||
El Síndrome de Beck-Fahrner, también conocido como "BEFAHRS" y "deficiencia de TET3", es un trastorno genético raro causado por mutaciones del gen TET3. La manifestación clínica varía entre individuos, pero suele incluir retraso global del desarrollo, progreso lento en actividades mentales y físicas, autismo, disminución del tono muscular, epilepsia y rasgos dismórficos.
Las mutaciones en el gen TET3 interrumpen la desmetilación del ADN durante la embriogénesis, un proceso epigenético esencial que contribuye al desarrollo temprano del sistema nervioso. Pueden producirse a partir de nuevas mutaciones genéticas o heredarse de forma autosómica dominante. El diagnóstico implica pruebas moleculares y genéticas en el contexto de los síntomas típicos. El tratamiento es de apoyo, con el objetivo de mejorar la calidad de vida. En 2023 se habían diagnosticado este síndrome a unos 50 individuos.
Signos y síntomas
El síndrome de Beck-Fahrner, también denominado "BEFAHRS", se caracteriza por una mnemotecnia que engloba sus rasgos más destacados: diferencias de comportamiento, epilepsia, rasgos faciales, rasgos autistas, hipotonía, retraso del desarrollo psicomotor y diferencias de tamaño.[1]
Los síntomas más comunes del neurodesarrollo asociados a este síndrome incluyen un retraso en el desarrollo global, un progreso lento en las actividades mentales y físicas, un retraso en el habla y dificultades con la motricidad fina y gruesa.[2] Es frecuente la presencia de discapacidades intelectuales y de aprendizaje, e incluso más de dos tercios de los individuos afectadas padecen autismo o trastornos de la comunicación social.[3] Además, se han observado trastornos por déficit de atención con hiperactividad, tendencias obsesivo-compulsivas, ansiedad, depresión y psicosis.[2]
La disminución del tono muscular es más evidente en los primeros años de vida, lo que provoca dificultades alimentarias y de estreñimiento en los lactantes e impide aún más el desarrollo del habla y de las habilidades motoras en los niños. La epilepsia y los trastornos convulsivos afectan a más de un tercio de la población, mientras que algunos presentan trastornos motores y del movimiento. La afectación ocular puede provocar problemas de visión, movimiento y alineación, mientras que la afectación auditiva puede ocasionar pérdida de audición. En ocasiones, los individuos afectados pueden presentar malformaciones cerebrales benignas en estudios de neuroimagen.[3]
La mayoría de los afectados por el síndrome de Beck-Fahrner presentan rasgos faciales similares, como cara alargada con frente ancha, boca abierta, orejas prominentes, cejas arqueadas y paladar alto. Las anomalías musculoesqueléticas abarcan cifosis, escoliosis, articulaciones hiperflexibles, desalineación de la cadera y pies planos.[3]El sobrecrecimiento puede manifestarse en algunos individuos, presentando características tales como un mayor tamaño de la cabeza y estatura alta;[2]en raras ocasiones esto puede estar correlacionado con riñones y corazón agrandados. Por el contrario, también se ha descrito un crecimiento insuficiente, asociado a una cabeza más pequeña y una estatura baja. Con menor frecuencia se han observado defectos cardíacos congénitos, estenosis pilórica, hernia inguinal, hipospadias y testículos no descendidos.[3]
Genética

El gen TET3 del cromosoma 2 (2p13.1) codifica la enzima TET metilcitosina dioxigenasa 3 (TET3).[4][nota 1] La enzima TET3 facilita la conversión de 5-metilcitosina (5mC) en 5-hidroximetilcitosina (5hmC), iniciando la desmetilación activa del ADN, un mecanismo epigenético.[6] La enzima TET3 se produce en las células madre embrionarias durante la embriogénesis, donde contribuye al desarrollo del sistema nervioso. Sostiene las células madre neurales y posteriormente promueve la maduración de las neuronas.[7]
El síndrome de Beck-Fahrner está causado por mutaciones específicas en el gen TET3. Estas mutaciones pueden ser heterocigosidas (una copia normal y una copia mutada), heterocigosidas compuestas (dos copias mutadas diferentes) u homocigosidas (dos copias mutadas idénticas).[8] Las mutaciones, que pueden ser de varios tipos (sin sentido, de sentido erróneo o contrasentido), interrumpen el proceso normal de desmetilación del ADN durante el desarrollo embrionario temprano y la formación del sistema nervioso. Esta alteración provoca un aumento de los sitios CpG metilados, lo que causa una hipermetilación del ADN.[2]
Las mutaciones pueden producirse durante la embriogénesis por nuevas mutaciones genéticas o heredarse de forma que una copia del gen mutado sea suficiente para causar la enfermedad de manera autosómica dominante. Los signos y síntomas pueden variar de un individuo a otro debido a diferencias en la expresión del gen y a la pérdida parcial de su función.[3]
Diagnóstico
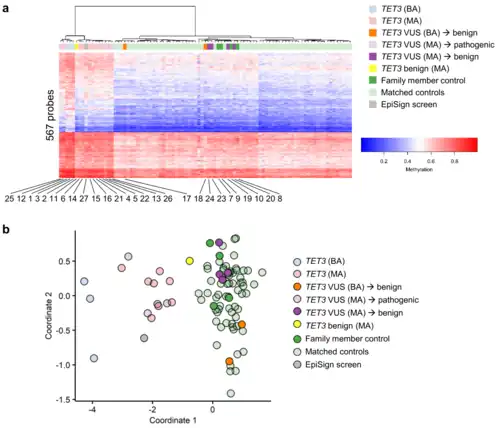
El síndrome de Beck-Fahrner presenta similitudes con varios trastornos genéticos en cuanto a los hallazgos clínicos. Entre ellos se incluyen los síndromes de Bainbridge-Ropers, X frágil, Heyn-Sproul-Jackson, Kabuki, Luscan-Lumish, Malan, Sotos y el síndrome de Tatton-Brown-Rahman. No existe consenso sobre los criterios diagnósticos del síndrome de Beck-Fahrner. El diagnóstico implica confirmar la presencia de una mutación patogénica o probablemente patogénica del gen TET3, junto con la identificación de los signos y síntomas característicos del síndrome.[3]
Para identificar las mutaciones asociadas al síndrome de Beck-Fahrner se emplean diversos métodos de pruebas moleculares y genéticas. Estos pueden incluir paneles multigénicos que incorporen el gen TET3, secuenciación del genoma completo, secuenciación del exoma, análisis de secuencias y pruebas de un solo gen seguidas de análisis de deleción o duplicación de genes específicos. GeneReviews recomienda la secuenciación del exoma como prueba diagnóstica preferida debido a la reciente identificación de la afección y a la disponibilidad limitada del análisis del gen TET3 en la mayoría de los paneles multigénicos.[3]
Levy y otros autores en 2021 descubrieron un patrón de metilación del ADN o firma epigenética distinto y único para las mutaciones patogénicas y probablemente patogénicas del gen TET3. Esta firma episódica puede evaluarse mediante el análisis de metilación del ADN en todo el genoma sanguíneo [1]y puede servir como herramienta para confirmar la patogenicidad de una variante de significado incierto de TET3.[9]
Tratamiento
El tratamiento del síndrome de Beck-Fahrner se centra principalmente en mejorar la calidad de vida y es de apoyo. La atención está coordinada por los servicios de genética médica y pediatría, con la participación de un equipo multidisciplinario de especialistas. Dependiendo de los síntomas específicos, pueden intervenir varios especialistas médicos, como neurología para las convulsiones y cardiología para los defectos cardíacos. Las intervenciones tempranas, como las terapias para el autismo y la participación en programas de educación especial como la terapia conductual y lenguaje, pueden ayudar a gestionar los problemas cognitivos y de desarrollo. La fisioterapia y la terapia ocupacional pueden ayudar a tratar los síntomas físicos, a su vez en caso necesario puede utilizarse tecnología de apoyo, como ayudas para la movilidad y un bipedestador.[3]
El asesoramiento genético desempeña un papel fundamental en la educación de los pacientes y sus familias sobre la enfermedad, la evaluación del riesgo de que otros miembros de la familia padezcan el trastorno, la orientación sobre planificación familiar y la información sobre pruebas prenatales. Además, el trabajo social ayuda a los pacientes y sus familias a explorar opciones de cuidados paliativos, de relevo y en residencias de ancianos cuando es necesario.[3]
Historia
En 2018, un estudio de investigación sugirió que las mutaciones en el gen TET3 podrían causar discapacidad intelectual.[10] El síndrome de Beck-Fahrner, inicialmente denominado "deficiencia de TET3",[2] se describió por primera vez en 2020.[11] Fue el primer trastorno humano de la desmetilación del ADN en describirse.[12] A partir de 2023, se ha diagnosticado esta condición a aproximadamente 50 individuos.[13]
Notas
- ↑ Las enzimas TET son una familia de metilcitosina dioxigenasas de "translocación diez-once" que participan en la desmetilación del ADN.[5]
Referencias
- ↑ a b Levy, Michael A. et al. (8 de noviembre de 2021). «Deficiency of TET3 leads to a genome-wide DNA hypermethylation episignature in human whole blood». npj Genomic Medicine (en inglés) (London (Inglaterra): Springer Nature) 6 (1): 92. ISSN 2056-7944. PMC 8576018. PMID 34750377. doi:10.1038/s41525-021-00256-y.
- ↑ a b c d e Beck, David B. et al. (9 de enero de 2020). «Delineation of a human mendelian disorder of the DNA demethylation machinery: TET3 deficiency». American Journal of Human Genetics (en inglés) (Rockville (Maryland): American Society of Human Genetics) 106 (2): 234-245. ISSN 0002-9297. PMC 7010978. PMID 31928709. doi:10.1016/j.ajhg.2019.12.007.
- ↑ a b c d e f g h i Fahrner, Jill A. (18 de mayo de 2023). «TET3-related Beck–Fahrner syndrome». GeneReviews (en inglés) (Seattle (Washington): University of Washington). PMID 37200470. Consultado el 15 de julio de 2023.
- ↑ «Symbol report for TET3». HUGO Gene Nomenclature Committee (en inglés). Farmington (Connecticut): Human Genome Organisation. Consultado el 20 de febrero de 2024.
- ↑ Bogdanovic, Ozren; Vermeulen, Michiel, eds. (2021). TET Proteins and DNA Demethylation: Methods and Protocols. Methods in Molecular Biology (en inglés) 2272. Londres (Inglaterra): Springer Nature. p. V. ISBN 978-1-0716-1293-4.
- ↑ Wu, Xiaoji; Zhang, Yi (1 de septiembre de 2017). «TET-mediated active DNA demethylation: mechanism, function and beyond». Nature Reviews Genetics (en inglés) (Londres (Inglaterra): Springer Nature) 18 (9): 517-534. ISSN 1471-0056. PMID 28555658. doi:10.1038/nrg.2017.33. Consultado el 30 de julio de 2023.
- ↑ Li, Ting et al. (18 de mayo de 2014). «Critical role of TET3 in neural progenitor cell maintenance and terminal differentiation». Molecular Neurobiology (en inglés) (Londres (Inglaterra): Springer Nature) 51 (1): 142-154. ISSN 0893-7648. PMID 24838624. doi:10.1007/s12035-014-8734-5. Consultado el 30 de julio de 2023.
- ↑ «Beck–Fahrner syndrome; BEFAHRS». Online Mendelian Inheritance in Man (en inglés). Baltimore (Maryland): Johns Hopkins University School of Medicine. 4 de marzo de 2020. Consultado el 15 de julio de 2023.
- ↑ Tollefsbol, Trygve, ed. (2023). Epigenetics in Human Disease. Translational Epigenetics Series (en inglés) 1 (3 edición). Ámsterdam (Países Bajos): Elsevier. p. 1277. ISBN 978-0-443-21812-5.
- ↑ Santos-Cortez, Regie Lyn P. et al. (22 de agosto de 2018). «Novel candidate genes and variants underlying autosomal recessive neurodevelopmental disorders with intellectual disability». Human Genetics (en inglés) (Londres (Inglaterra): Springer Nature) 137 (9): 735-752. ISSN 1432-1203. PMC 6201268. PMID 30167849. doi:10.1007/s00439-018-1928-6.
- ↑ Cohn, Ronald; Scherer, Stephen, eds. (2023). Thompson & Thompson Genetics and Genomics in Medicine (en inglés) (9 edición). Amsterdam: Elsevier. p. 145. ISBN 978-0-323-55328-5.
- ↑ Ng, Rowena; Kalinousky, Allison; Harris, Jacqueline (27 de mayo de 2023). «Epigenetics of cognition and behavior: insights from Mendelian disorders of epigenetic machinery». Journal of Neurodevelopmental Disorders (en inglés) (Londres (Inglaterra): BioMed Central) 15 (1): 16. PMC 10224589. PMID 37245029. doi:10.1186/s11689-023-09482-0.
- ↑ Doherty, Megan (16 de junio de 2023). «Ashley Clifford is one of only 50 people with Beck–Fahrner syndrome». The Canberra Times (en inglés) (Australian Community Media). Archivado desde el original el 18 de febrero de 2024. Consultado el 23 de julio de 2023.
Enlaces externos
 Wikimedia Commons alberga una galería multimedia sobre Síndrome de Beck-Fahrner.
Wikimedia Commons alberga una galería multimedia sobre Síndrome de Beck-Fahrner.