Tetranitruro de tetraazufre
| Tetranitruro de tetraazufre | ||
|---|---|---|
 | ||
| Nombre IUPAC | ||
| Tetranitruro de tetraazufre | ||
| General | ||
| Fórmula semidesarrollada | S4N4 | |
| Fórmula estructural |
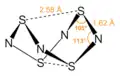 | |
| Fórmula molecular | ? | |
| Identificadores | ||
| Número CAS | 28950-34-7[1] | |
| ChemSpider | 124788 | |
| PubChem | 141455 | |
| UNII | 9BXS997HR6 | |
| Propiedades físicas | ||
| Apariencia | Sólido anaranjado | |
| Masa molar | 184,29 g/mol | |
| Punto de fusión | 460 K (187 °C) | |
| Propiedades químicas | ||
| Solubilidad en agua | Insoluble | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
El tetranitruro de tetraazufre es un compuesto inorgánico con fórmula S4N4. Este sólido de color oro anaranjado es el compuesto binario más importante entre los nitruros de azufre, que son compuestos que contienen sólo el elemento azufre y el nitrógeno. Es un precursor de muchos compuestos con enlaces S-N y ha atraído un amplio interés por su estructura y enlaces inusuales.[2][3]
El nitrógeno y el azufre tienen electronegatividades similares. Debido a esto, cuando los átomos se unen, se forma una extensa red de estructuras unidas covalentemente. Sin embargo, un gran número de compuestos de S-N y S-NH derivan del S4N4.
Propiedades
El S4N4 es estable en aire. Sin embargo, es inestable desde el punto de vista termodinámico, con una entalpía de formación positiva de 460 kJ/mol. Esta entalpía endotérmica de formación se debe a la diferencia de energía del S4N4 en comparación con sus productos de descomposición altamente estables:
- 2 S
4N
4 → 4 N
2 + S
8
El S4N4 es sensible al choque y a la fricción y, dado que uno de sus productos de descomposición es un gas, se considera un explosivo primario.[4][5]
Las muestras más puras tienden a ser más sensibles.[6]
Las muestras pequeñas pueden detonarse golpeándolas con un martillo. El S4N4 es termocrómico, cambiando de amarillo pálido por debajo de -30 °C a naranja a temperatura ambiente y a rojo intenso por encima de 100 °C.[2]
Referencias
- ↑ Número CAS
- ↑ a b Greenwood, N. N.; Earnshaw, A. Chemical Elements; 2nd edition; Butterworth-Heinemann: Boston, MA, 1997, pp 721-725.
- ↑ Chivers, T. “A Guide To Chalcogen-Nitrogen Chemistry” World Scientific Publishing Company: Singapore; 2004. ISBN 981-256-095-5
- ↑ Greenwood, N. N.; Earnshaw, A. (1997). Chemical Elements (2nd edición). Boston, MA: Butterworth-Heinemann. pp. 721-725.
- ↑ Assessment, US EPA National Center for Environmental (15 de marzo de 2009). «Analysis of the Explosive Properties of Tetrasulfur Tetranitride, S4N4». hero.epa.gov (en inglés). Consultado el 24 de mayo de 2024.
- ↑ Ebrahimian, G. Reza; Fuchs, Philip L. (15 de marzo de 2009), «Tetrasulfur Tetranitride», en John Wiley & Sons, Ltd, ed., Encyclopedia of Reagents for Organic Synthesis (en inglés) (Chichester, UK: John Wiley & Sons, Ltd), ISBN 978-0-471-93623-7, doi:10.1002/047084289x.rn00933, consultado el 24 de mayo de 2024.