Vía alternativa de síntesis de andrógenos
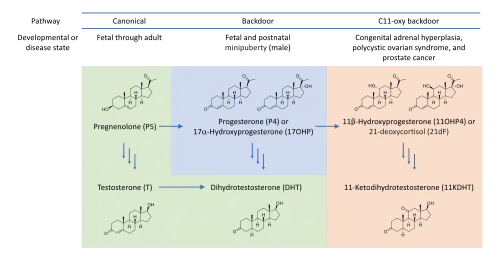
La vía alternativa de síntesis de andrógenos o vía de puerta trasera (Androgen backdoor pathway) es responsable de la síntesis de andrógenos fisiológicamente relevantes. Este proceso comienza con esteroides de 21 carbonos (C
21), también conocidos como pregnanos, e implica un paso denominado "5α-reducción". Cabe destacar que esta vía no requiere la formación intermedia de testosterona, de ahí que en la literatura médica se utilice a veces el término "evitar la testosterona" (bypassing en inglés) como característica distintiva de esta forma de biosíntesis de andrógenos. Esta característica es una distinción clave de la vía androgénica convencional y canónica, que necesita la participación de la testosterona como intermediario en la síntesis de andrógenos.
Estas vías androgénicas alternativas desempeñan un papel crucial en el desarrollo sexual masculino temprano. En individuos con hiperplasia suprarrenal congénita debida a deficiencias enzimáticas como la 21-hidroxilasa o la deficiencia de citocromo P450 oxidorreductasa, estas vías pueden activarse a cualquier edad con un aumento de los niveles de precursores como la progesterona o la 17α-hidroxiprogesterona. Esta activación puede provocar síntomas de hiperandrogenismo como acné, hirsutismo, síndrome de ovario poliquístico o agrandamiento de la próstata.
En la vía canónica, la dihidrotestosterona se sintetiza directamente a partir de la testosterona mediante la enzima 5α-reductasa, principalmente en tejidos como la próstata, los folículos pilosos y la piel. Ambas vías dependen de la 5α-reductasa, pero en la vía de la puerta trasera de los andrógenos, esta enzima actúa sobre los esteroides C21 (pregnanos), iniciando una serie de reacciones químicas que finalmente conducen a la producción de dihidrotestosterona. En cambio, en la vía canónica, la 5α-reductasa se dirige al doble enlace 4,5 de la testosterona, produciendo dihidrotestosterona directamente.
La vía de la puerta trasera se describió inicialmente como una ruta biosintética en la que la 5α-reducción de la 17α-hidroxiprogesterona conduce en última instancia a la dihidrotestosterona. Desde entonces, se han descubierto varias otras vías que conducen a andrógenos 11-oxigenados que también son fisiológicamente significativos.
Función
Los andrógenos que se unen al receptor androgénico y lo activan tienen numerosas funciones fisiológicas que pueden dividirse a grandes rasgos en androgénicas (desarrollo sexual masculino) y anabólicas (desarrollo muscular y óseo). Los efectos anabólicos son importantes tanto en hombres como en mujeres, aunque las mujeres tienen niveles circulantes de andrógenos más bajos. Los andrógenos fisiológicamente más importantes son la testosterona (T) y la dihidrotestosterona (DHT), que se consideran andrógenos clásicos porque su función en la salud humana se descubrió en la década de 1930.[1] Sin embargo, mucho más tarde, en la década de 2010,[2] se estableció el papel en la salud humana de los andrógenos 11-oxigenados, es decir, de la 11-cetotestosterona (11KT) y la 11-cetodihidrotestosterona (11KDHT), que se unen y activan el receptor androgénico humano con afinidades, potencias, y eficacias que son similares a la de la testosterona (T) y DHT, respectivamente,[3][2][4] aunque los andrógenos 11-oxigenados eran conocidos desde hace tiempo por ser los principales andrógenos en peces teleósteos.[2]
La principal ruta bioquímica hacia la T y la DHT es la vía canónica (clásica) que procede de la pregnenolona (P5). Alternativamente, la DHT pero no la T puede producirse a través de una vía secundaria que procede de la 17α-hidroxiprogesterona (17OHP) o progesterona (P4). La función de las vías secundarias de andrógenos es producir andrógenos fisiológicamente significativos en condiciones normales en las que la vía convencional es insuficiente, como en la diferenciación sexual masculina temprana.[5][3]La diferenciación sexual es un proceso por el que las hormonas determinan el fenotipo anatómico, principalmente el desarrollo de los órganos reproductores.[6] La DHT es la hormona androgénica más importante y es un producto tanto de la vía canónica como de la vía backdoor.[7] Además, la 11KDHT, pero no la 11KT, puede biosintetizarse a partir de la vía backdoor C11-oxi a partir de la progesterona (P4).Estos andrógenos C11-oxi pueden contribuir a la patología de la hiperplasia suprarrenal congénita, el síndrome de ovario poliquístico y el cáncer de próstata.[7][8]
La vía de la puerta trasera de los andrógenos se activa durante el desarrollo prenatal normal y conduce a la diferenciación sexual masculina temprana.[5][9][10] La dihidrotestosterona sintetizada por esta vía desempeña un papel fundamental en el desarrollo de los caracteres sexuales masculinos, incluida la diferenciación y maduración de los genitales externos masculinos, la glándula prostática y otras estructuras reproductivas masculinas.[11] Al eludir los intermediarios convencionales (A4 y T), esta vía garantiza el desarrollo oportuno y adecuado de los caracteres sexuales masculinos en etapas embrionarias y fetales tempranas. Tanto la vía canónica como la vía de la puerta trasera son esenciales en el desarrollo embrionario masculino normal.[12][5][13] Una alteración en la vía de la puerta trasera puede conducir a una diferenciación sexual masculina incompleta o alterada.Las consecuencias específicas pueden variar en función de la naturaleza y el alcance de la alteración y pueden dar lugar a trastornos como genitales ambiguos u otros trastornos del desarrollo sexual (DSD), en los que las características físicas y sexuales del individuo no se alinean claramente con las típicas masculinas, es decir, la subvirilización de los bebés varones.[12][6]La subvirilización se refiere al desarrollo insuficiente de las características masculinas debido a los efectos inferiores a lo normal de los andrógenos durante el desarrollo prenatal. Después del nacimiento, puede manifestarse como genitales masculinos marcadamente subdesarrollados.[14]
La vía secundaria de la biosíntesis de DHT de 17OHP a DHT se describió por primera vez en los marsupiales y posteriormente se confirmó en humanos.[15][16][6]Tanto la vía canónica como la secundaria de la biosíntesis de DHT son necesarias para el desarrollo normal de los genitales masculinos en humanos. Por lo tanto, los defectos en la vía secundaria de 17α-hidroxiprogesterona (17OHP) o progesterona (P4) a DHT conducen a la subvirilización en fetos masculinos porque la P4 placentaria es el precursor de DHT a través de la vía secundaria.[12]
En la deficiencia de 21-hidroxilasa[17] o la deficiencia de citocromo P450 oxidorreductasa,[18] incluso un aumento leve de los niveles circulantes de P4[19][20][21] o 17-OHP puede activar esta vía, independientemente de la edad y el sexo del paciente.[22][23]
Mecanismo
Señalización androgénica
El mecanismo de respuesta androgénica implica la unión de andrógenos a receptores androgénicos en el citoplasma, que luego se trasladan al núcleo y controlan la transcripción de genes mediante la interacción con regiones específicas del ADN denominadas elementos de respuesta androgénica.[24] Este mecanismo de respuesta desempeña un papel crucial en la diferenciación sexual masculina y en la pubertad, así como en otros tipos de tejidos y procesos, como la glándula prostática (regula las funciones secretoras), los folículos pilosos (los andrógenos influyen en los patrones de crecimiento del pelo), la piel (los andrógenos regulan la producción de sebo y el engrosamiento y maduración de la piel) y los músculos (contribuyen al desarrollo y mantenimiento de la masa y la fuerza muscular).[25][26]
Los distintos andrógenos tienen diferentes efectos sobre los receptores androgénicos porque tienen diferentes grados de unión y activación de los receptores. Los andrógenos fisiológicamente significativos son aquellos andrógenos que tienen una fuerte influencia en el desarrollo y funcionamiento de los caracteres sexuales masculinos, a diferencia de los andrógenos fisiológicamente insignificantes, que tienen una baja actividad biológica o se metabolizan rápidamente en otros esteroides. Los andrógenos fisiológicamente insignificantes no tienen una influencia notable en el desarrollo y funcionamiento de los caracteres sexuales masculinos o femeninos, pueden ser productos del metabolismo de andrógenos más activos, como la testosterona (T), o de sus precursores.[27]
Biosíntesis de andrógenos

Las vías de retroceso de andrógenos son vitales para crear andrógenos a partir de esteroides de 21 carbonos (C21), conocidos como pregnanos. Un esteroide de 21 carbonos es una molécula de esteroides con 21 átomos de carbono,[29] por lo tanto, su fórmula química contiene C21. Por ejemplo, la fórmula química de la progesterona es C21H30O2. Es por eso que los esteroides de 21 átomos de carbono se denominan C21-esteroides, los esteroides de 19 átomos de carbono se denominan C19 esteroides, y así sucesivamente.[30] Las vías secundarias de andrógenos ocurren sin la participación de testosterona (T) y/o androstenediona (A4), que son parte de la vía androgénica convencional, canónica (clásica).[31][32][11]
En las vías canónicas de la biosíntesis de andrógenos, la DHT se sintetiza a partir de la T mediante 5α-reducción, de modo que la 5α-reducción de la T, un esteroide C19, es el último paso de la vía (véase Dihidrotestosterona § Biosíntesis).[31][15][33] En las vías secundarias, por el contrario, la 5α-reducción de los esteroides C21 es el primer paso. La 5α-reducción es una reacción química en la que un grupo funcional unido al carbono en la posición 5α del núcleo del esteroide se reduce, y un doble enlace entre los átomos de carbono numerados 4 y 5 (ver § Figura 2) en la molécula de esteroide se sustituye por el enlace simple en una reacción química catalizada por la enzima SRD5A1 (ver ejemplos en la § Figura 3 denotados por flechas marcadas por "SRD5A1" en el recuadro cuadrado).[3]
Las vías secundarias androgénicas también pueden activarse en condiciones patológicas (enfermedades), como la hiperplasia suprarrenal congénita (HSC), que conduce al hiperandrogenismo.[29][8]
Bioquímica
Biosíntesis canónica

En la vía canónica de biosíntesis de andrógenos, la dihidrotestosterona (DHT) se sintetiza irreversiblemente a partir de la testosterona (T) mediante la enzima 5α-reductasa,[29][35][36] mientras que la T se sintetiza a partir del androstenediol (A5) o la androstenediona (A4), que son todos esteroides C19 (andrógenos).[29] La 5α-reducción de la T se produce en varios tejidos, como los genitales (pene, escroto, clítoris, labios mayores),[37] la glándula prostática, la piel, los folículos pilosos, el hígado y el cerebro.[35] Alrededor del 5 al 7% de la T sufre una 5α-reducción a DHT en adultos varones.[38][39] La mayor parte de la DHT se produce en tejidos periféricos como la piel y el hígado (denominados tejidos diana), mientras que la mayor parte de la DHT circulante se origina específicamente en el hígado. Los testículos y la próstata contribuyen relativamente poco a las concentraciones de DHT en circulación.[35]
Biosíntesis de puerta trasera
| Gen | Vía enzimática | Vía enzimática | Preferencia Direccional | Distribución Tisular |
|---|---|---|---|---|
| AKR1C1 | 3α-HSD4 | Puerta trasera | Reductor | Hígado, testículos, pulmón, mama, útero, cerebro |
| AKR1C2 | 3α-HSD3 | Puerta trasera | Reductor | Hígado, próstata, pulmón, útero, cerebro |
| AKR1C3 | 3α-HSD2 | Puerta trasera | Reductor | Próstata, mama, hígado, suprarrenales, testículos, pulmón |
| AKR1C4 | 3α-HSD1 | Puerta trasera | Reductor | Hígado >> suprarrenales/gónadas |
| HSD3B1 | 3β-HSD1 | Puerta trasera/Canónico | Oxidativo | Testículos, suprarrenales, placenta |
| HSD3B2 | 3β-HSD2 | Puerta trasera/Canónico | Oxidativo | Testículos, suprarrenales |
| HSD17B3 | 17β-HSD3 | Puerta trasera/Canónico | Oxidativo | Células de Leydig (testículos) |
| HSD17B6 | 17β-HSD6 (RoDH) | Puerta trasera | Oxidativo | Próstata |
| SRD5A1 | 5α-reductasa, tipo 1 | Puerta trasera/Canónico | Reductor | Amplia expresión tisular |
| SRD5A2 | 5α-reductasa, tipo 2 | Puerta trasera/Canónico | Reductor | Próstata |
| SRD5A3 | 5α-reductasa, tipo 3 | Puerta trasera/Canónico | Reductor | Amplia expresión tisular |
| StAR | proteína reguladora aguda esteroidogénica | Puerta trasera/Canónico | N/A | Glándula suprarrenal y células de Leydig |
| CYP11A1 | P450scc | Puerta trasera/Canónico | Oxidativo | Glándula suprarrenal y testículos |
| CYP17A1 | Esteroide 17-alfa-hidroxilasa | Puerta trasera/Canónico | Oxidativo | Glándula suprarrenal y testículos |
| POR | citocromo b5, P450 oxidorreductasa | Puerta trasera/Canónico | N/A | Hígado, niveles más bajos en otros tejidos |
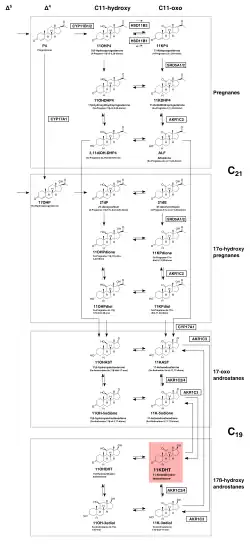
Lo que distingue la vía backdoor de los andrógenos de la vía clásica es si la 5α-reducción inicia o termina la vía. En la vía de la puerta trasera, la 5α-reducción de la progesterona (P4) o de la 17α-hidroxiprogesterona (17OHP) se produce al principio o cerca del principio de la vía, respectivamente.[40][29][17]Por el contrario, en la vía clásica, la 5α-reducción es el paso final, en el que la testosterona se convierte en dihidrotestosterona (DHT).[3]
La vía de la puerta trasera se divide en dos subvías en P4, pasando por 17OHP o 5α-DHP antes de unirse de nuevo en 5α-Pdiol. El intermediario biosintético 5α-Pdiol a su vez se convierte en DHT en dos pasos químicos.
Subvía del 17OHP
El primer paso de esta vía es la 5α-reducción de 17OHP a 5α-pregnan-17α-ol-3,20-diona (referida como 17OHDHP o 17α-hidroxi-dihidroprogesterona).[3]La reacción es catalizada por SRD5A1.[41] La 17OHDHP se convierte entonces en 5α-pregnano-3α,17α-diol-20-ona (5α-Pdiol) vía 3α-reducción por una isoenzima 3α-hidroxiesteroide deshidrogenasa (AKR1C2 y AKR1C4)[42][43][15]o HSD17B6, que también tiene actividad de 3α-reducción.[44][45] La vía procede entonces del 5α-Pdiol de la misma manera que la vía que parte del P4, es decir, 5α-Pdiol → AST → 3α-diol → DHT.[29]
La vía puede resumirse como: 17OHP → 17OHDHP → 5α-Pdiol → AST → 3α-diol → DHT.[29][3]
Subvía del 5α-DHP
La vía de la progesterona (P4) a la DHT es similar a la descrita anteriormente de 17OHP a DHT, pero el sustrato inicial para la 5α-reductasa es P4 en lugar de 17OHP. La P4 placentaria en el feto masculino es la materia prima, es decir, un punto de partida, el sustrato inicial, para la vía de la puerta trasera que se encuentra operando en múltiples tejidos no gonadales.[42][15][43]
El primer paso en esta vía es la 5α-reducción de P4 hacia 5α-dihidroprogesterona (5α-DHP) por SRD5A1.[43][15] [42]5α-DHP es entonces convertida a alopregnanolona (AlloP5) vía 3α-reducción por AKR1C2 o AKR1C4.[29][3]AlloP5 se convierte entonces en 5α-Pdiol por la actividad 17α-hidroxilasa de CYP17A1.[42][15][43]5α-Pdiol también se conoce como 17α-hidroxiallopregnanolona o 17OH-allopregnanolona.[46][47][12]5α-Pdiol se convierte entonces en 5α-androstan-3α-ol-17-ona, también conocida como androsterona (AST) por la actividad 17,20-liasa de CYP17A1 que escinde una cadena lateral (enlace C17-C20) del núcleo esteroide, convirtiendo un esteroide C21 (un pregnano) en un esteroide C19 (un androstano o andrógeno).[29] [3]El AST es 17β-reducido a 5α-androstano-3α,17β-diol (3α-diol) por HSD17B3 o AKR1C3.[33] El paso final es la 3α-oxidación del 3α-diol en los tejidos diana a DHT por una enzima que tiene actividad 3α-hidroxiesteroide oxidasa, como AKR1C2, HSD17B6, HSD17B10, RDH16, RDH5 y DHRS9. Esta oxidación no es necesaria en la vía androgénica clásica.[48][49][29]La vía puede resumirse como: P4 → 5α-DHP → AlloP5 → 5α-Pdiol → AST → 3α-diol → DHT.[29]
Biosíntesis de la puerta trasera de andrógenos 11 oxigenados
Se conocen dos andrógenos 11-oxigenados fisiológica y clínicamente significativos, la 11-cetotestosterona (11KT) y la 11-cetodihidrotestosterona (11KDHT), que se unen y activan el receptor androgénico con afinidades, potencias y eficacias similares a las de la testosterona (T) y la DHT, respectivamente.[4][3]
En cuanto a la 11β-hidroxitestosterona (11OHT) y la 11β-hidroxi-dihidrotestosterona (11OHDHT), la androgenicidad de estos esteroides es un punto de investigación. Aunque algunos estudios,[51][8][4][25]sugieren que si bien la 11β-hidroxitestosterona (11OHT) y la 11β-hidroxi-dihidrotestosterona (11OHDHT) pueden no tener una actividad androgénica significativa como se creía que poseían, aún pueden ser precursores importantes de moléculas androgénicas. La importancia relativa de los andrógenos depende de su actividad, niveles circulantes y estabilidad. Se ha establecido que los esteroides 11β-hidroxiandrostenediona (11OHA4) y 11-cetoandrostenediona (11KA4) tienen una actividad androgénica mínima, pero siguen siendo moléculas importantes en este contexto, ya que actúan como precursores de andrógenos.[52][53][2][4]
Sin embargo, de todos los andrógenos 11-oxigenados fisiológica y clínicamente significativos, sólo la 11KDHT (pero no la 11KT) se biosintetiza a través de una vía secundaria.[54][55][22]
Las vías secundarias a los andrógenos 11-oxigenados pueden definirse a grandes rasgos como dos puntos de entrada de esteroides Δ4 (17OHP y P4, véase la figura 4) que pueden sufrir una secuencia común de varias transformaciones:[54][22]
- 11β-hidroxilación de 17OHP o P4 por CYP11B1 en la corteza suprarrenal en 21dF o 11OHP4, respectivamente,[54][22]
- 5α-reducción por SRD5A1/SRD5A2,[54][22]
- escisión de una cadena lateral (enlace C17-C20) del núcleo del esteroide por la actividad 17,20-liasa de CYP17A1 que convierte un esteroide C21 en un esteroide C19,[54]
- 17β-reducción por AKR1C3 (un grupo funcional oxo (=O) en posición 17β sustituido al grupo funcional hidroxilo (-OH)),[54][22]
- reversible 11β-reducción/oxidación de la cetona/alcohol (un grupo funcional oxo (=O) o hidroxilo (-OH), respectivamente) por HSD11B1/HSD11B2.[54][22]
- reversible 3β-reducción/oxidación de la cetona/alcohol (un grupo funcional oxo (=O) o hidroxilo (-OH), respectivamente) por AKR1C2 o AKR1C4.[54][22][56]
Importancia clínica
Hiperplasia suprarrenal congénita.
En la hiperplasia suprarrenal congénita (HSC) debida a la deficiencia de 21-hidroxilasa o citocromo P450 oxidorreductasa (POR),[22][57][12] los elevados niveles asociados de 17OHP resultan en el flujo a través de la vía de puerta trasera a DHT que comienza con la 5α-reducción de 17OHP.[3]En las mujeres adultas, el exceso de andrógenos puede causar hirsutismo (crecimiento excesivo de vello), alopecia (pérdida de vello), irregularidades menstruales, infertilidad y síndrome de ovario poliquístico.[58][59][8]En los hombres adultos, el exceso de andrógenos puede causar agrandamiento de la próstata, cáncer de próstata y reducción de la calidad del esperma. En adultos de ambos sexos, el exceso de andrógenos también puede causar alteraciones metabólicas, como resistencia a la insulina, dislipidemia, hipertensión y enfermedades cardiovasculares.[59]En el feto, el exceso de andrógenos debido al exceso de 17OHP fetal en la HSC puede contribuir a la síntesis de DHT que conduce a la virilización genital externa en niñas recién nacidas con HSC.[43][60][61][62] Los niveles de P4 también pueden estar elevados en la HSC,[62]lo que conduce a un exceso de andrógenos a través de la vía secundaria de P4 a DHT.[63] 17OHP y P4 también pueden servir como sustratos para los andrógenos 11-oxigenados en la HSC.[55][3]
La masculinización de los genitales externos femeninos en un feto debido a la ingesta de ciertas hormonas exógenas por parte de la madre -la denominada virilización inducida por progestágenos- suele ser menos notable que en la hiperplasia suprarrenal congénita (HSC) y, a diferencia de la HSC, no causa virilización progresiva.[64]
Se sabe que los niveles séricos de los esteroides C21 11-oxigenados: 21-deoxicorticosterona, también conocida como 11β-hidroxiprogesterona (11OHP4) y 21-deoxicortisol (21dF), están elevados tanto en las formas no clásicas como clásicas de HSC,[65][66][67] y se han propuesto perfiles de cromatografía líquida-espectrometría de masas que incluyen estos esteroides para aplicaciones clínicas,[68][69] incluido el cribado neonatal.[22]Los pacientes con HSC clásica que recibían tratamiento con glucocorticoides tenían niveles séricos de esteroides C19 11-oxigenados elevados en comparación con los controles sanos.[62][70][71] En pacientes con HSC con mal control de la enfermedad, los andrógenos 11-oxigenados permanecen elevados durante más tiempo que la 17OHP, por lo que sirven como un mejor biomarcador de la eficacia del control de la enfermedad.[71][70][62]En varones con HSC, los niveles de andrógenos 11-oxigenados pueden indicar la presencia de tumores de resto suprarrenal testicular.[72][62]
Desarrollo del aparato reproductor
Para que los genitales masculinos se desarrollen adecuadamente en los seres humanos, tanto la vía clásica como la vía de la puerta trasera son esenciales como medios de biosíntesis de DHT.[5][12]Las deficiencias en la vía de la puerta trasera que convierte 17OHP o P4 en DHT pueden dar lugar a la subvirilización del feto masculino.[73][74] Esta subvirilización puede ocurrir porque la P4 placentaria actúa como un importante precursor de la DHT fetal específicamente dentro de la vía de la puerta trasera que no debe interrumpirse.[41]
La subvirilización se refiere a una masculinización incompleta del feto masculino. Puede tener consecuencias como genitales ambiguos u órganos reproductores subdesarrollados, incluidos el pene y los testículos.[75] Estas afecciones pueden repercutir en la fertilidad, la función sexual y también pueden afectar a la identidad de género general del individuo más adelante en la vida.[76]
Un estudio de caso en el que participaron cinco individuos con un patrón cromosómico 46,XY (masculino) de dos familias reveló que su DSD, manifestado en un aspecto genital inusual, estaba causado por mutaciones en los genes AKR1C2 y/o AKR1C4. Estos genes están implicados exclusivamente en la vía secundaria de producción de dihidrotestosterona (DHT). Las mutaciones en el AKR1C3 y los genes implicados en la vía androgénica clásica se excluyeron como causas del aspecto genital atípico. Curiosamente, sus parientes femeninas con un patrón cromosómico 46,XX que tenían las mismas mutaciones presentaban características físicas y fertilidad normales. Aunque tanto la enzima AKR1C2 como la AKR1C4 son necesarias para la síntesis de DHT en una vía de puerta trasera, el estudio descubrió que las mutaciones en AKR1C2 sólo eran suficientes para la alteración. Sin embargo, estas variantes de AKR1C2/AKR1C4 que conducen a la DSD son raras y sólo se han descrito hasta ahora en esas dos familias.[77] Este estudio de caso pone de relieve el papel de AKR1C2/4 en las vías androgénicas alternativas.[77][3][6]
El síndrome de deficiencia aislada de 17,20-liasa debido a variantes en CYP17A1, citocromo b5 y POR también puede interrumpir la vía secundaria a DHT, ya que la actividad 17,20-liasa de CYP17A1 es necesaria tanto para la vía clásica como para la vía secundaria a andrógenos.[73]Esta deficiencia poco frecuente puede provocar DSD en ambos sexos, siendo las niñas afectadas asintomáticas hasta la pubertad, cuando muestran amenorrea.[77]
Los andrógenos 11-oxigenados pueden desempeñar papeles importantes en los DSD.[78][60][31] La biosíntesis fetal de andrógenos 11-oxigenados puede coincidir con las etapas clave de la producción de cortisol: en las semanas 8-9, 13-24, y de la 31 en adelante. En estas etapas, el deterioro de la actividad de CYP17A1 y CYP21A2 conduce a un aumento de ACTH debido a la deficiencia de cortisol y a la acumulación de sustratos para CYP11B1 en las vías a andrógenos 11-oxigenados y podría causar un desarrollo fetal femenino anormal (virilización).[78][22]
Hiperplasia prostática benigna y prostatitis
Se sabe que los andrógenos desempeñan un papel crucial en las afecciones relacionadas con la próstata, como la hiperplasia prostática benigna (HPB), la prostatitis crónica/síndrome de dolor pélvico crónico (CP/CPPS) y el cáncer de próstata.[79] En la HPB, se ha identificado que los esteroides C21 11-oxigenados (pregnanos) son precursores de los andrógenos.[80] En concreto, esteroides como la 11β-hidroxiprogesterona (11OHP4) y la 11-cetoprogesterona (11KP4) pueden convertirse en 11-cetodihidrotestosterona (11KDHT), una forma 11-oxo de DHT con la misma potencia. Estos precursores también se han detectado en muestras de biopsias de tejidos de pacientes con HBP, así como en sus niveles séricos. La relación entre los niveles séricos de esteroides y la CP/CPPS sugiere que las deficiencias en la enzima CYP21A2 pueden contribuir al desarrollo de esta afección. La hiperplasia suprarrenal congénita no clásica (HSC) resultante de la deficiencia de CYP21A2 se considera normalmente asintomática en los hombres. Sin embargo, la HSC no clásica podría ser una comorbilidad asociada al CP/CPPS.[81][82][83]
Cáncer de próstata
La vía secundaria a la DHT desempeña un papel en el desarrollo de cánceres sensibles a los andrógenos, como el cáncer de próstata. En algunos casos, se ha descubierto que las células tumorales poseen niveles más elevados de enzimas implicadas en esta vía, lo que se traduce en una mayor producción de DHT.[84][4][7]
La terapia de privación androgénica (TPA) es un tratamiento común para el cáncer de próstata, que implica la reducción de los niveles de andrógenos, específicamente T y DHT, en el cuerpo.[85] Este tratamiento se realiza mediante el uso de medicamentos que tienen como objetivo bloquear la producción o la acción de estas hormonas. Aunque la ADT puede ser eficaz para frenar el crecimiento del cáncer de próstata, también tiene varios inconvenientes, uno de los cuales es el potencial de aumento de la producción de P4 y la activación de la vía secundaria de la biosíntesis de DHT, en la que la P4 sirve de sustrato. Normalmente, esta vía no es muy activa en varones adultos sanos, ya que la mayor parte de la DHT se produce a través de la vía clásica, que implica la conversión directa de T en DHT por una de las isozimas SRD5A. Sin embargo, cuando los niveles de T se reducen a través de ADT, el cuerpo puede compensar mediante el aumento de la producción de P4, que puede servir como sustrato para la vía de puerta trasera. Uno de los principales inconvenientes de este aumento de la producción de P4 es el aumento de los niveles de DHT, que estimula el crecimiento de las células cancerosas de la próstata. Este aumento de la producción de P4 y DHT puede hacer que el cáncer se vuelva resistente a la ADT y continúe creciendo y extendiéndose. Además, el aumento de los niveles de P4 también puede causar efectos secundarios como aumento de peso, fatiga y cambios de humor (cambios extremos o rápidos del estado de ánimo).[85]
En el cáncer de próstata, la eliminación de la T testicular mediante la castración (extirpación quirúrgica o química o inactivación de los testículos) ayuda a eliminar los efectos promotores del crecimiento de los andrógenos.[85] Sin embargo, en algunos casos, los tumores metastásicos pueden convertirse en cáncer de próstata resistente a la castración (CPRC).[86] Mientras que la castración reduce los niveles séricos de T en un 90-95%, sólo disminuye la DHT en la glándula prostática en un 50%. Esta diferencia entre la magnitud de los niveles de andrógenos confirma que la próstata tiene enzimas capaces de producir DHT incluso sin T testicular.[79] Además de la producción de DHT dentro de la próstata, los investigadores descubrieron que los andrógenos 11-oxigenados desempeñan un papel en el mantenimiento de los niveles totales del pool de andrógenos circulantes, que son relevantes para las cantidades de andrógenos clínicamente significativas en el organismo.[87][51] [4]Estos andrógenos 11-oxigenados contribuyen en gran medida a reactivar la señalización androgénica en pacientes con CPRC.[85][33]Los andrógenos 11-oxigenados constituyen alrededor del 60% del conjunto total de andrógenos activos en estos pacientes. A diferencia de la T o la DHT, estos niveles de andrógenos 11-oxigenados no se ven afectados por la terapia de castración.[85]
Historia
La vía de la puerta trasera de la biosíntesis de DHT fue descubierta a principios de la década del 2000 en los marsupiales y posteriormente confirmada en humanos.[15] Es por eso que la vía de la puerta trasera de la biosíntesis de DHT a partir de 17OHP puede ser llamada vía marsupial.[6]Esta vía también está presente en otros mamíferos,[88][89] como las ratas, y se estudian en los otros mamíferos como una forma de entender mejor estas vías en humanos.[29][88][41]
Los marsupiales y, en particular, los ualabíes tammar (Notamacropus eugenii)[90] son especialmente útiles para estudiar los procesos de diferenciación sexual y desarrollo en el contexto de la biosíntesis de andrógenos,[6][91] porque la diferenciación sexual en estas especies se produce sólo después del nacimiento, con los testículos que comienzan a formarse dos días después del nacimiento y los ovarios sólo en el octavo día después del nacimiento. Esta característica de diferenciación sexual temprana postnatal permite estudiar la influencia de las hormonas en el organismo desde el inicio del proceso de diferenciación sexual, así como las vías de biosíntesis de estas hormonas. Los wallabíes tammar son particularmente interesantes debido al hecho de que todas estas hormonas, vías, y las formas en que las hormonas afectan a las características corporales y al crecimiento de los diferentes órganos se pueden estudiar cuando el organismo ya ha nacido, a diferencia de lo que ocurre en otros mamíferos como las ratas, donde la diferenciación sexual en un feto se produce dentro de la placenta antes del nacimiento.[92][93][94]
El descubrimiento de la vía oculta para la biosíntesis de DHT en las crías de wallaby tammar impulsó la investigación para identificar y caracterizar vías similares en los seres humanos, lo que condujo a una mejor comprensión de la regulación, el metabolismo y la orientación terapéutica de la biosíntesis de andrógenos en la salud humana y las enfermedades relacionadas con la biosíntesis excesiva o insuficiente de andrógenos cuando la vía clásica de andrógenos no podía explicar completamente las afecciones observadas en los pacientes.[6][90]En las dos décadas siguientes se descubrieron otras vías distintas: las vías que conducen a la síntesis de andrógenos 11-oxigenados.[4][54][95]
A continuación se presenta una breve selección de los acontecimientos clave en la historia de la investigación de la vía secundaria de los andrógenos:[3]
- En 2000, Shaw et al.[9]demostraron que el 3α-diol circulante media el desarrollo de la próstata en las crías de wallaby tammar mediante su conversión a DHT en los tejidos diana.[16]Las crías de wallaby tammar no muestran niveles circulantes sexualmente dimórficos de T y DHT durante el desarrollo de la próstata, lo que sugiere que fue otro mecanismo de androgenización el responsable.[94][96] Aunque la afinidad de unión del 3α-diol al receptor androgénico es cinco órdenes de magnitud inferior a la de la DHT (el 3α-diol se describe generalmente como inactivo para el receptor androgénico), se sabía que el 3α-diol puede oxidarse de nuevo a DHT mediante la acción de una serie de deshidrogenasas.[97][98][99]
- En 2003, Wilson et al.[90]demostraron que la expresión de 5α-reductasa en los tejidos diana permitía una nueva vía de 17OHP a 3α-diol sin T o A4 como intermediario.[90]
- En 2004, Mahendroo et al.[10] demostraron que en los testículos de ratón funciona una nueva vía superpuesta, generalizando lo que se había demostrado en el canguro hormiguero.[16][99][100][101]
- El término "vía de la puerta trasera" fue acuñado por Auchus en 2004[29]y se describió como la 5α-reducción de la 17α-hidroxiprogesterona (17OHP), que es un primer paso en una vía que en última instancia conduce a la producción de dihidrotestosterona (DHT). y se definió como una ruta hacia la DHT que: (1) evita los intermediarios convencionales androstenediona (A4) y T; (2) implica 5α-reducción de C21 pregnanos a C19 androstanos; y (3) implica la 3α-oxidación de 3α-diol a DHT.[102] La vía de la puerta trasera explica cómo se producen andrógenos en determinadas condiciones normales y patológicas en humanos cuando la vía androgénica clásica no puede explicar completamente las consecuencias observadas.[5][103][104]
- La relevancia clínica de los resultados publicados por Auchus en 2004 se demostró por primera vez en 2012 cuando Kamrath et al.[17] atribuyeron los metabolitos urinarios a la vía de la puerta trasera de los andrógenos de 17OHP a DHT en pacientes con deficiencia de la enzima esteroide 21-hidroxilasa (codificada por el gen CYP21A2).[105][106][107]
- Barnard et al.[5] en 2017 demostraron vías metabólicas de esteroides C21 a 11KDHT que eluden A4 y T, un aspecto que es similar al de la vía de puerta trasera a DHT. Estas vías recién descubiertas a andrógenos 11-oxigenados también se describieron como vías de "puerta trasera" debido a esta similitud, y se caracterizaron más en estudios posteriores.[108][55][3]
Véase también
Referencias
- ↑ Nieschlag E, Nieschlag S (Junio 2019). "Endocrine history: The history of discovery, synthesis and development of testosterone for clinical use". secondary. Eur J Endocrinol. 180 (6): R201 – R212.Doi : 10.1530/EJE-19-0071. PMID: 30959485 .
- ↑ a b c d Pretorius E, Arlt W, Storbeck KH (Febrero 2017). "A new dawn for androgens: Novel lessons from 11-oxygenated C19 steroids" (PDF). secondary. Mol Cell Endocrinol. 441: 76–85. doi:10.1016/j.mce.2016.08.014. PMID 27519632. S2CID 4079662. Archivado (PDF) del original 9 febrero 2021. Consultado 26 Febrero 2024.
- ↑ a b c d e f g h i j k l m n Masiutin MM, Yadav MK (3 Abril 2023). "Alternative androgen pathways" (PDF). WikiJournal of Medicine. 10: 29. doi:10.15347/WJM/2023.003. S2CID 257943362. Archivado (PDF)del original 24/10/2023. Consultado 10 Abril 2024
- ↑ a b c d e f g Snaterse G, Hofland J, Lapauw B (01/2023). "The role of 11-oxygenated androgens in prostate cancer". secondary. Endocr Oncol. 3 (1): e220072. doi:10.1530/EO-22-0072. PMC 10305623. PMID 37434644.
- ↑ a b c d e f Miller WL, Auchus RJ (Abril 2019). "The "backdoor pathway" of androgen synthesis in human male sexual development". secondary. PLOS Biol. 17 (4): e3000198. doi:10.1371/journal.pbio.3000198. PMC 6464227. PMID 30943210.
- ↑ a b c d e f g h Biason-Lauber A, Pandey AV, Miller WL, Flück CE (01/2014). "Marsupial pathway in humans.". In New MI, Lekarev O, Parsa A, Yuen TT, O'Malley B, Hammer GD (eds.). Genetic Steroid Disorders. secondary. Academic Press. pp. 215–224. doi:10.1016/B978-0-12-416006-4.00015-6. ISBN 978-0-12-416006-4. Archivado del original 1/01/2024. Consultado 1/01/2024.
- ↑ a b c Turcu AF, Rege J, Auchus RJ, Rainey WE (Mayo 2020). "11-Oxygenated androgens in health and disease". secondary. Nature Reviews. Endocrinology. 16 (5): 284–296. doi:10.1038/s41574-020-0336-x. PMC 7881526. PMID 32203405.
- ↑ a b c d Wang K, Li Y, Chen Y (2023). "Androgen excess: a hallmark of polycystic ovary syndrome". secondary. Front Endocrinol (Lausanne). 14: 1273542. doi:10.3389/fendo.2023.1273542. PMC 10751361. PMID 38152131.
- ↑ a b Shaw G, Renfree MB, Leihy MW, Shackleton CH, Roitman E, Wilson JD (10/2000). "Prostate formation in a marsupial is mediated by the testicular androgen 5 alpha-androstane-3 alpha,17 beta-diol". primary. Proceedings of the National Academy of Sciences of the United States of America. 97 (22): 12256–12259. Bibcode:2000PNAS...9712256S. doi:10.1073/pnas.220412297. PMC 17328. PMID 11035809.
- ↑ a b Mahendroo M, Wilson JD, Richardson JA, Auchus RJ (July 2004). "Steroid 5alpha-reductase 1 promotes 5alpha-androstane-3alpha,17beta-diol synthesis in immature mouse testes by two pathways". primary. Molecular and Cellular Endocrinology. 222 (1–2): 113–120. doi:10.1016/j.mce.2004.04.009. PMID 15249131. S2CID 54297812.
- ↑ a b Burris-Hiday SD, Scott EE (Mayo 2021). "Steroidogenic cytochrome P450 17A1 structure and function". secondary. Mol Cell Endocrinol. 528: 111261. doi:10.1016/j.mce.2021.111261. PMC 8087655. PMID 33781841.
- ↑ a b c d e f Lee HG, Kim CJ (Junio 2022). "Classic and backdoor pathways of androgen biosynthesis in human sexual development". secondary. Annals of Pediatric Endocrinology & Metabolism. 27 (2): 83–89. doi:10.6065/apem.2244124.062. PMC 9260366. PMID 35793998. S2CID 250155674.
- ↑ Sharpe RM (08/2020). "Androgens and the masculinization programming window: human-rodent differences". secondary. Biochemical Society Transactions. 48 (4): 1725–1735. doi:10.1042/BST20200200. PMC 7458408. PMID 32779695.
- ↑ Josso N (Mayo 2004). "The undervirilized male child: endocrine aspects". secondary. BJU Int. 93 (Suppl 3): 3–5. doi:10.1111/j.1464-410X.2004.04702.x. PMID 15086435. S2CID 35565574.
- ↑ a b c d e f g Lawrence BM, O'Donnell L, Smith LB, Rebourcet D (12/2022). "New Insights into Testosterone Biosynthesis: Novel Observations from HSD17B3 Deficient Mice". secondary. International Journal of Molecular Sciences. 23 (24): 15555. doi:10.3390/ijms232415555. PMC 9779265. PMID 36555196.
- ↑ a b c Connan-Perrot S, Léger T, Lelandais P, Desdoits-Lethimonier C, David A, Fowler PA, et al. (Junio 2021). "Six Decades of Research on Human Fetal Gonadal Steroids". secondary. Int J Mol Sci. 22 (13): 6681. doi:10.3390/ijms22136681. PMC 8268622. PMID 34206462.
- ↑ a b c Kamrath C, Hochberg Z, Hartmann MF, Remer T, Wudy SA (Marzo 2012). "Increased activation of the alternative "backdoor" pathway in patients with 21-hydroxylase deficiency: evidence from urinary steroid hormone analysis". primary. The Journal of Clinical Endocrinology and Metabolism. 97 (3): E367 – E375. doi:10.1210/jc.2011-1997. PMID 22170725. S2CID 3162065.
- ↑ Reisch N, Taylor AE, Nogueira EF, Asby DJ, Dhir V, Berry A, et al. (10/2019). "Alternative pathway androgen biosynthesis and human fetal female virilization". secondary. Proc Natl Acad Sci U S A. 116 (44): 22294–22299. Bibcode:2019PNAS..11622294R. doi:10.1073/pnas.1906623116. PMC 6825302. PMID 31611378.
- ↑ Luu-The V (09/2013). "Assessment of steroidogenesis and steroidogenic enzyme functions". J Steroid Biochem Mol Biol. 137: 176–82. doi:10.1016/j.jsbmb.2013.05.017. PMID 23770321.
- ↑ Kamrath C, Hartmann MF, Wudy SA (02/2013). "Androgen synthesis in patients with congenital adrenal hyperplasia due to 21-hydroxylase deficiency". Horm Metab Res. 45 (2): 86–91. doi:10.1055/s-0032-1331751. PMID 23345132.
- ↑ Melmed S, Auchus RJ, Goldfine AB, Rosen CJ, Kopp PA (3 Abril 2024). Williams Textbook of Endocrinology E-Book. Elsevier Health Sciences. ISBN 9780323933476.
- ↑ a b c d e f g h i j k de Hora M, Heather N, Webster D, Albert B, Hofman P (2023). "The use of liquid chromatography-tandem mass spectrometry in newborn screening for congenital adrenal hyperplasia: improvements and future perspectives". secondary. Frontiers in Endocrinology. 14: 1226284. doi:10.3389/fendo.2023.1226284. PMC 10578435. PMID 37850096.
In 2004, a "backdoor" pathway was described with a metabolic route from 17OHP to DHT that does not involve A4 or T. In CAH, accumulating 17OHP is 5α- and 3α- reduced before being converted to androsterone by CYP17A1 with subsequent reduction and oxidation steps yielding DHT (44). Urinary steroid profiles in babies with CAH revealed that this pathway is active in CAH in the newborn period (45). The backdoor pathway may also make further contributions to the total androgen pool in CAH in the newborn period. In vitro studies have demonstrated that 11-hydroxylated corticosteroids such as 21DF, 21-deoxycortisone (21DE) and 11β-hydroxyprogesterone (11βOHP) can be converted by backdoor pathway enzymes to yield 11-ketodihydrotestosterone (11KDHT) (46), an androgen with a similar potency to DHT ( Figure 1 ). Almost 60 years ago, Jailer and colleagues demonstrated that 21DF and not 17OHP dosing resulted in increased 11-hydroxyandrosterone (11OHAST) excretion, an indication that 21DF is an androgen precursor (47). Whether the route is via the backdoor pathway or by the direct conversion of 21DF to 11OHA4 via CYP17A1, 21DF may be an important contributor to the androgen pool in CAH.
- ↑ Sumińska M, Bogusz-Górna K, Wegner D, Fichna M (Junio 2020). "Non-Classic Disorder of Adrenal Steroidogenesis and Clinical Dilemmas in 21-Hydroxylase Deficiency Combined with Backdoor Androgen Pathway. Mini-Review and Case Report". secondary. International Journal of Molecular Sciences. 21 (13): 4622. doi:10.3390/ijms2113462
- ↑ Van-Duyne G, Blair IA, Sprenger C, Moiseenkova-Bell V, Plymate S, Penning TM (2023). "The androgen receptor". Vitamins and Hormones. secondary. Vol. 123. pp. 439–481. doi:10.1016/bs.vh.2023.01.001. ISBN 978-0-443-13455-5 PMID 37717994.
- ↑ a b Alemany M (10/2022). "The Roles of Androgens in Humans: Biology, Metabolic Regulation and Health". secondary. International Journal of Molecular Sciences. 23 (19): 11952. doi:10.3390/ijms231911952. PMC 9569951. PMID 36233256.
- ↑ Ceruti JM, Leirós GJ, Balañá ME (Abril 2018). "Androgens and androgen receptor action in skin and hair follicles". secondary. Molecular and Cellular Endocrinology. 465: 122–133. doi:10.1016/j.mce.2017.09.009. hdl:11336/88192. PMID 28912032. S2CID 3951518.
- ↑ Cussen L, McDonnell T, Bennett G, Thompson CJ, Sherlock M, O'Reilly MW (08/2022). "Approach to androgen excess in women: Clinical and biochemical insights". secondary. Clin Endocrinol (Oxf). 97 (2): 174–186. doi:10.1111/cen.14710. PMC 9541126. PMID 35349173.
- ↑ Masiutin MM, Yadav MK (3 de abril de 2023). "Alternative androgen pathways" (PDF). WikiJournal of Medicine. 10: 29. doi:10.15347/WJM/2023.003. S2CID 257943362. Archivado (PDF) desde el original el 24 de octubre de 2023. Recuperado el 10 de abril de 2024
- ↑ a b c d e f g h i j k l m Auchus RJ (11/2004). "The backdoor pathway to dihydrotestosterone". secondary. Trends in Endocrinology and Metabolism. 15 (9): 432–438. doi:10.1016/j.tem.2004.09.004. PMID 15519890. S2CID 10631647.
21-carbon steroids can be converted to 19-carbon steroids by a third pathway. The unique feature of the pathway is the 5a-reduction of the 21-carbon precursors, which leads to 19-carbon products that are 5a-reduced. We call this the backdoor pathway to DHT because AD and T are not intermediates to DHT
- ↑ "Progesterone". secondary. National Library of Medicine. Archivado del original 21/12/2023. Consultado 1/01/2024.
- ↑ a b c Kater CE, Giorgi RB, Costa-Barbosa FA (Marzo 2022). "Classic and current concepts in adrenal steroidogenesis: a reappraisal". secondary. Archives of Endocrinology and Metabolism. 66 (1): 77–87. doi:10.20945/2359-3997000000438. PMC 9991025. PMID 35263051.
- ↑ Naamneh Elzenaty R, du Toit T, Flück CE (Julio 2022). "Basics of androgen synthesis and action". secondary. Best Pract Res Clin Endocrinol Metab. 36 (4): 101665. doi:10.1016/j.beem.2022.101665. PMID 35595638. S2CID 248624649. Archivado del original 15/02/2024. Consultado 15/02/2024.
- ↑ a b c Storbeck KH, Mostaghel EA (2019). "Canonical and Noncanonical Androgen Metabolism and Activity". Prostate Cancer. secondary. Advances in Experimental Medicine and Biology. Vol. 1210. Springer. pp. 239–277. doi:10.1007/978-3-030-32656-2_11. ISBN 978-3-030-32655-5. PMID 31900912. S2CID 209748543.
- ↑ Biason-Lauber A, Pandey AV, Miller WL, Flück CE (January 2014). "Marsupial pathway in humans.". In New MI, Lekarev O, Parsa A, Yuen TT, O'Malley B, Hammer GD (eds.). Genetic Steroid Disorders. secondary. Academic Press. pp. 215–224. doi:10.1016/B978-0-12-416006-4.00015-6. ISBN 978-0-12-416006-4. Archivado desde el original el 1 de enero de 2024. Recuperado el 1 de enero de 2024.
- ↑ a b c Melmed S (2016). Williams Textbook of Endocrinology. secondary. Elsevier Health Sciences. pp. 621, 711. ISBN 978-0-323-29738-7.
- ↑ Blume-Peytavi U, Whiting DA, Trüeb RM (2008). Hair Growth and Disorders. secondary. Springer Science & Business Media. pp. 161–62. ISBN 978-3-540-46911-7. Archivado del original 11/01/2023. Consultado 5/02/2024.
- ↑ Rhoades RA, Bell DR (2012). Medical Physiology: Principles for Clinical Medicine. secondary. Lippincott Williams & Wilkins. pp. 690–. ISBN 978-1-60913-427-3.
- ↑ Rakel D (2012). Integrative Medicine E-Book. secondary. Elsevier Health Sciences. pp. 321–. ISBN 978-1-4557-2503-8.
- ↑ Morrison MF (2000). Hormones, Gender and the Aging Brain: The Endocrine Basis of Geriatric Psychiatry. secondary. Cambridge University Press. pp. 17–. ISBN 978-1-139-42645-9.
- ↑ Kinter KJ, Anekar AA (2021). Biochemistry, Dihydrotestosterone. secondary. StatPearls. PMID 32491566. NCBI NBK557634.
- ↑ a b c Fukami M, Homma K, Hasegawa T, Ogata T (Abril 2013). "Backdoor pathway for dihydrotestosterone biosynthesis: implications for normal and abnormal human sex development". secondary. Developmental Dynamics. 242 (4): 320–329. doi:10.1002/dvdy.23892. PMID 23073980. S2CID 44702659.
- ↑ a b c d Bhattacharya I, Dey S (2022). "Emerging concepts on Leydig cell development in fetal and adult testis". secondary. Front Endocrinol (Lausanne). 13: 1086276. doi:10.3389/fendo.2022.1086276. PMC 9851038. PMID 36686449.
- ↑ a b c d e Pignatti E, du Toit T, Flück CE (02/2023). "Development and function of the fetal adrenal". secondary. Rev Endocr Metab Disord. 24 (1): 5–21. doi:10.1007/s11154-022-09756-3. PMC 9884658. PMID 36255414.
- ↑ Biswas MG, Russell DW (Junio 1997). "Expression cloning and characterization of oxidative 17beta- and 3alpha-hydroxysteroid dehydrogenases from rat and human prostate". secondary. The Journal of Biological Chemistry. 272 (25): 15959–15966. doi:10.1074/jbc.272.25.15959. PMID 9188497.
- ↑ Muthusamy S, Andersson S, Kim HJ, Butler R, Waage L, Bergerheim U, et al. (12/2011). "Estrogen receptor β and 17β-hydroxysteroid dehydrogenase type 6, a growth regulatory pathway that is lost in prostate cancer". secondary. Proceedings of the National Academy of Sciences of the United States of America. 108 (50): 20090–20094. Bibcode:2011PNAS..10820090M. doi:10.1073/pnas.1117772108. PMC 3250130. PMID 22114194.
- ↑ Wu Y, Tang L, Azabdaftari G, Pop E, Smith GJ (Abril 2019). "Adrenal androgens rescue prostatic dihydrotestosterone production and growth of prostate cancer cells after castration". secondary. Mol Cell Endocrinol. 486: 79–88. doi:10.1016/j.mce.2019.02.018. PMC 6438375. PMID 30807787.
- ↑ Merke DP, Poppas DP (12/2013). "Management of adolescents with congenital adrenal hyperplasia". secondary. Lancet Diabetes Endocrinol. 1 (4): 341–52. doi:10.1016/S2213-8587(13)70138-4. PMC 4163910. PMID 24622419.
- ↑ Li S, Lee W, Heo W, Son HY, Her Y, Kim JI, et al. (02/2023). "AKR1C2 Promotes Metastasis and Regulates the Molecular Features of Luminal Androgen Receptor Subtype in Triple Negative Breast Cancer Cells". secondary. J Breast Cancer. 26 (1): 60–76. doi:10.4048/jbc.2023.26.e1. PMC 9981988. PMID 36762781.
- ↑ Mantel A, Carpenter-Mendini AB, Vanbuskirk JB, De Benedetto A, Beck LA, Pentland AP (Abril 2012). "Aldo-keto reductase 1C3 is expressed in differentiated human epidermis, affects keratinocyte differentiation, and is upregulated in atopic dermatitis". secondary. J Invest Dermatol. 132 (4): 1103–10. doi:10.1038/jid.2011.412. PMC 3305848. PMID 22170488.
- ↑ a b Masiutin MM, Yadav MK (3 de abril de 2023). "Alternative androgen pathways" (PDF). WikiJournal of Medicine. 10: 29. doi:10.15347/WJM/2023.003. S2CID 257943362. Archivado (PDF) desde el original el 24 de octubre de 2023. Recuperado el 10 de abril de 2024.
- ↑ a b Snaterse G, Mies R, van Weerden WM, French PJ, Jonker JW, Houtsmuller AB, et al. (Junio 2023). "Androgen receptor mutations modulate activation by 11-oxygenated androgens and glucocorticoids". secondary (Meta-Analysis). Prostate Cancer and Prostatic Diseases. 26 (2): 293–301. doi:10.1038/s41391-022-00491-z. PMID 35046557. S2CID 246040148. Archivado del original 24/02/2024. Consultado 19/10/2023.
- ↑ Yin L, Qi S, Zhu Z (2023). "Advances in mitochondria-centered mechanism behind the roles of androgens and androgen receptor in the regulation of glucose and lipid metabolism". secondary. Front Endocrinol (Lausanne). 14: 1267170. doi:10.3389/fendo.2023.1267170. PMC 10613047. PMID 37900128.
- ↑ Fukami M (2022). "11-Oxyandrogens from the viewpoint of pediatric endocrinology". secondary. Clin Pediatr Endocrinol. 31 (3): 110–115. doi:10.1297/cpe.2022-0029. PMC 9297174. PMID 35928376.
- ↑ a b c d e f g h i Barnard L, Gent R, van Rooyen D, Swart AC (11/2017). "Adrenal C11-oxy C21 steroids contribute to the C11-oxy C19 steroid pool via the backdoor pathway in the biosynthesis and metabolism of 21-deoxycortisol and 21-deoxycortisone". secondary. The Journal of Steroid Biochemistry and Molecular Biology. 174: 86–95. doi:10.1016/j.jsbmb.2017.07.034. PMID 28774496. S2CID 24071400.
The downstream metabolism of 21dF and 21dE by the enzymes in the backdoor pathway, SRD5A and AKR1C2, was investigated and the resulting novel C11‐oxy C21 steroids, 5α‐pregnan-3α,11β,17-triol-20-one (11OHPdiol) and 5α-pregnan-3α,17-diol-11,20-dione (11KPdiol), were shown to be suitable substrates for the lyase activity of CYP17A1, resulting in the production of C11-oxy C19 steroid metabolites 11β‐hydroxyandrosterone (11OHAST) and 11‐ketoandrosterone (11KAST) [...] The interconversion of 21dF and 21dE by 11βHSD yielded two C11-oxy C21 steroids which our in vitro assays showed are metabolised by steroidogenic enzymes in the backdoor pathway to yield C11-oxy C19 androgens. [...] the backdoor pathway may include the 5α-reduction of 21dF and 21dE in these patients and, as a consequence, the production of potent androgens, 11OHDHT and 11KDHT.
- ↑ a b c van Rooyen D, Yadav R, Scott EE, Swart AC (Mayo 2020). "CYP17A1 exhibits 17αhydroxylase/17,20-lyase activity towards 11β-hydroxyprogesterone and 11-ketoprogesterone metabolites in the C11-oxy backdoor pathway". primary. The Journal of Steroid Biochemistry and Molecular Biology. 199: 105614. doi:10.1016/j.jsbmb.2020.105614. PMID 32007561. S2CID 210955834.
[...] steroidogenic research has focused on the metabolism of the C11-oxy C21 steroids in backdoor pathway yielding potent androgens (Fig. 1). Increased activation of the pathway and elevated enzyme expression levels are more frequently reported in the human fetus and ovaries and in clinical conditions which include 21OHD and adrenocortical tumours. [...] The detection of C11-oxy steroids in clinical conditions associated with increased backdoor pathway activity led us to investigate the catalytic activity of CYP17A1 towards the C11-oxy C21 steroids potentially contributing to the androgen pool.
- ↑ Turcu AF, Nanba AT, Auchus RJ (2018). "The Rise, Fall, and Resurrection of 11-Oxygenated Androgens in Human Physiology and Disease". secondary. Hormone Research in Paediatrics. 89 (5): 284–291. doi:10.1159/000486036. PMC 6031471. PMID 29742491.
- ↑ Claahsen-van der Grinten HL, Speiser PW, Ahmed SF, Arlt W, Auchus RJ, Falhammar H, et al. (01/2022). "Congenital Adrenal Hyperplasia-Current Insights in Pathophysiology, Diagnostics, and Management". secondary. Endocr Rev. 43 (1): 91–159. doi:10.1210/endrev/bnab016. PMC 8755999. PMID 33961029.
- ↑ Turcu AF, Auchus RJ (Junio 2015). "Adrenal steroidogenesis and congenital adrenal hyperplasia". secondary. Endocrinology and Metabolism Clinics of North America. 44 (2). Elsevier BV: 275–296. doi:10.1016/j.ecl.2015.02.002. PMC 4506691. PMID 26038201.
- ↑ a b Bacila IA, Elder C, Krone N (12/2019). "Update on adrenal steroid hormone biosynthesis and clinical implications" (PDF). secondary. Arch Dis Child. 104 (12): 1223–1228. doi:10.1136/archdischild-2017-313873. PMID 31175123. S2CID 182950024. Archivado del (PDF)original 13/12/2023. Consultado 13/12/2023.
- ↑ a b Finkielstain GP, Vieites A, Bergadá I, Rey RA (2021). "Disorders of Sex Development of Adrenal Origin". secondary. Frontiers in Endocrinology. 12: 770782. doi:10.3389/fendo.2021.770782. PMC 8720965. PMID 34987475.
- ↑ Inkster AM, Fernández-Boyano I, Robinson WP (Julio 2021). "Sex Differences Are Here to Stay: Relevance to Prenatal Care". secondary. J Clin Med. 10 (13): 3000. doi:10.3390/jcm10133000. PMC 8268816. PMID 34279482.
- ↑ a b c d e Sarafoglou K, Merke DP, Reisch N, Claahsen-van der Grinten H, Falhammar H, Auchus RJ (08/2023). "Interpretation of Steroid Biomarkers in 21-Hydroxylase Deficiency and Their Use in Disease Management". secondary. J Clin Endocrinol Metab. 108 (9): 2154–2175. doi:10.1210/clinem/dgad134. PMC 10438890. PMID 36950738.
- ↑ Ntali G, Charisis S, Kylafi CF, Vogiatzi E, Michala L (Julio 2021). "The way toward adulthood for females with nonclassic congenital adrenal hyperplasia". secondary. Endocrine. 73 (1): 16–30. doi:10.1007/s12020-021-02715-z. PMID 33855677. S2CID 233237454.
- ↑ Schardein JL (1980). "Congenital abnormalities and hormones during pregnancy: a clinical review". secondary. Teratology. 22 (3): 251–70. doi:10.1002/tera.1420220302. PMID 7015547.
- ↑ Di Cosola M, Spirito F, Zhurakivska K, Nocini R, Lovero R, Sembronio S, et al. (2022). "Congenital adrenal hyperplasia. Role of dentist in early diagnosis". secondary. Open Med (Wars). 17 (1): 1699–1704. doi:10.1515/med-2022-0524. PMC 9616050. PMID 36382053.
- ↑ Adriaansen BP, Schröder MA, Span PN, Sweep FC, van Herwaarden AE, Claahsen-van der Grinten HL (2022). "Challenges in treatment of patients with non-classic congenital adrenal hyperplasia". secondary. Front Endocrinol (Lausanne). 13: 1064024. doi:10.3389/fendo.2022.1064024. PMC 9791115. PMID 36578966.
- ↑ Falhammar H, Nordenström A (09/2015). "Nonclassic congenital adrenal hyperplasia due to 21-hydroxylase deficiency: clinical presentation, diagnosis, treatment, and outcome". secondary. Endocrine. 50 (1): 32–50. doi:10.1007/s12020-015-0656-0. PMID 26082286. S2CID 23469344.
- ↑ French D (Abril 2023). "Clinical utility of laboratory developed mass spectrometry assays for steroid hormone testing". secondary. J Mass Spectrom Adv Clin Lab. 28: 13–19. doi:10.1016/j.jmsacl.2023.01.006. PMC 9900367. PMID 36756146.
- ↑ Falhammar H, Thorén M (Junio2012). "Clinical outcomes in the management of congenital adrenal hyperplasia". secondary. Endocrine. 41 (3): 355–73. doi:10.1007/s12020-011-9591-x. PMID 22228497. S2CID 22387824.
- ↑ a b Itonaga T, Hasegawa Y (2023). "Monitoring treatment in pediatric patients with 21-hydroxylase deficiency". Front Endocrinol (Lausanne). 14: 1102741. doi:10.3389/fendo.2023.1102741. PMC 9945343. PMID 36843618.
- ↑ a b Mallappa A, Merke DP (Junio 2022). "Management challenges and therapeutic advances in congenital adrenal hyperplasia". secondary. Nat Rev Endocrinol. 18 (6): 337–352. doi:10.1038/s41574-022-00655-w. PMC 8999997. PMID 35411073.
- ↑ Turcu AF, Mallappa A, Elman MS, Avila NA, Marko J, Rao H, et al. (08/2017). "11-Oxygenated Androgens Are Biomarkers of Adrenal Volume and Testicular Adrenal Rest Tumors in 21-Hydroxylase Deficiency". primary. The Journal of Clinical Endocrinology and Metabolism. 102 (8): 2701–2710. doi:10.1210/jc.2016-3989. PMC 5546849. PMID 28472487.
- ↑ a b Flück CE, Pandey AV (Mayo 2014). "Steroidogenesis of the testis – new genes and pathways". secondary. Annales d'Endocrinologie. 75 (2): 40–47. doi:10.1016/j.ando.2014.03.002. PMID 24793988.
- ↑ Stratakis CA, Bossis I (Marzo 2004). "Genetics of the adrenal gland". secondary. Rev Endocr Metab Disord. 5 (1): 53–68. doi:10.1023/B:REMD.0000016124.44064.8f. PMID 14966389. S2CID 22128921.
- ↑ Batista RL, Mendonca BB (2022). "The Molecular Basis of 5α-Reductase Type 2 Deficiency". secondary. Sex Dev. 16 (2–3): 171–183. doi:10.1159/000525119. PMID 35793650. S2CID 250337336.
- ↑ Sultan C, Lumbroso S, Paris F, Jeandel C, Terouanne B, Belon C, et al. (08/2002). "Disorders of androgen action". secondary. Semin Reprod Med. 20 (3): 217–28. doi:10.1055/s-2002-35386. PMID 12428202. S2CID 41205149.
- ↑ a b c Boettcher C, Flück CE (01/2022). "Rare forms of genetic steroidogenic defects affecting the gonads and adrenals" (PDF). secondary. Best Practice & Research. Clinical Endocrinology & Metabolism. 36 (1): 101593. doi:10.1016/j.beem.2021.101593. PMID 34711511. S2CID 242536877. Archivado (PDF) del original 3/12/2023. Consultado 2/02/2024.
- ↑ a b du Toit T, Swart AC (09/2021). "Turning the spotlight on the C11-oxy androgens in human fetal development". secondary. The Journal of Steroid Biochemistry and Molecular Biology. 212: 105946. doi:10.1016/j.jsbmb.2021.105946. PMID 34171490. S2CID 235603586.
- ↑ a b Luu-The V, Bélanger A, Labrie F (2008). "Androgen biosynthetic pathways in the human prostate". secondary. Best Practice & Research. Clinical Endocrinology & Metabolism. 22 (2). Elsevier BV: 207–221. doi:10.1016/j.beem.2008.01.008. ISSN 1521-690X. PMID 18471780.
- ↑ Pena VN, Engel N, Gabrielson AT, Rabinowitz MJ, Herati AS (10/2021). "Diagnostic and Management Strategies for Patients with Chronic Prostatitis and Chronic Pelvic Pain Syndrome". secondary. Drugs Aging. 38 (10): 845–886. doi:10.1007/s40266-021-00890-2. PMID 34586623. S2CID 238208708.
- ↑ du Toit T, Swart AC (2020). "The 11β-hydroxyandrostenedione pathway and C11-oxy C21 backdoor pathway are active in benign prostatic hyperplasia yielding 11keto-testosterone and 11keto-progesterone". secondary. The Journal of Steroid Biochemistry and Molecular Biology. 196: 105497. doi:10.1016/j.jsbmb.2019.105497. PMID 31626910. S2CID 204734045.
- ↑ Masiutin MG, Yadav MK (2022). "Letter to the editor regarding the article "Adrenocortical hormone abnormalities in men with chronic prostatitis/chronic pelvic pain syndrome"". secondary. Urology. 169: 273. doi:10.1016/j.urology.2022.07.051. ISSN 0090-4295. PMID 35987379. S2CID 251657694. Archivado del original 30 Junio 2023. Consultado 1/01/2024.
- ↑ Dimitrakoff J, Nickel JC (2022). "Author reply". secondary. Urology. 169: 273–274. doi:10.1016/j.urology.2022.07.049. ISSN 0090-4295. PMID 35985522. S2CID 251658492. Archivado del original 30 Junio 2023. Consultado 1/01/2024.
- ↑ Gent R, Van Rooyen D, Atkin SL, Swart AC (12/2023). "C11-hydroxy and C11-oxo C19 and C21 Steroids: Pre-Receptor Regulation and Interaction with Androgen and Progesterone Steroid Receptors". Int J Mol Sci. 25 (1): 101. doi:10.3390/ijms25010101. PMC 10778819. PMID 38203272.
- ↑ a b c d e du Toit T, Swart AC (02/2018). "Inefficient UGT-conjugation of adrenal 11β-hydroxyandrostenedione metabolites highlights C11-oxy C19 steroids as the predominant androgens in prostate cancer". Mol Cell Endocrinol. 461: 265–276. doi:10.1016/j.mce.2017.09.026. PMID 28939401. S2CID 6335125.
- ↑ Krishnan S, Kanthaje S, Punchappady DR, Mujeeburahiman M, Ratnacaram CK (March 2023). "Circulating metabolite biomarkers: a game changer in the human prostate cancer diagnosis". J Cancer Res Clin Oncol. 149 (3): 951–967. doi:10.1007/s00432-022-04113-y. PMID 35764700. S2CID 250094257.
- ↑ Dai C, Dehm SM, Sharifi N (09/2023). "Targeting the Androgen Signaling Axis in Prostate Cancer". J Clin Oncol. 41 (26): 4267–4278. doi:10.1200/JCO.23.00433. PMC 10852396. PMID 37429011.
- ↑ a b Renfree MB, Shaw G (09/2023). "The alternate pathway of androgen metabolism and window of sensitivity". primary. J Endocrinol. 258 (3). doi:10.1530/JOE-22-0296. PMID 37343228. S2CID 259222117.
- ↑ Draskau MK, Svingen T (2022). "Azole Fungicides and Their Endocrine Disrupting Properties: Perspectives on Sex Hormone-Dependent Reproductive Development". secondary. Front Toxicol. 4: 883254. doi:10.3389/ftox.2022.883254. PMC 9097791. PMID 35573275.
- ↑ a b c d Wilson JD (2003). "5alpha-androstane-3alpha,17beta-diol is formed in tammar wallaby pouch young testes by a pathway involving 5alpha-pregnane-3alpha,17alpha-diol-20-one as a key intermediate". primary. Endocrinology. 144 (2): 575–80. doi:10.1210/en.2002-220721. PMID 12538619. S2CID 84765868.
- ↑ Biason-Lauber A, Miller WL, Pandey AV, Flück CE (Mayo 2013). "Of marsupials and men: "Backdoor" dihydrotestosterone synthesis in male sexual differentiation". secondary. Mol Cell Endocrinol. 371 (1–2): 124–32. doi:10.1016/j.mce.2013.01.017. PMID 23376007. S2CID 3102436.
- ↑ Leihy MW, Shaw G, Wilson JD, Renfree MB (Julio 2004). "Penile development is initiated in the tammar wallaby pouch young during the period when 5alpha-androstane-3alpha,17beta-diol is secreted by the testes". primary. Endocrinology. 145 (7): 3346–52. doi:10.1210/en.2004-0150. PMID 15059957.
- ↑ Glickman SE, Short RV, Renfree MB (11/2005). "Sexual differentiation in three unconventional mammals: spotted hyenas, elephants and tammar wallabies". secondary. Horm Behav. 48 (4): 403–17. doi:10.1016/j.yhbeh.2005.07.013. PMID 16197946. S2CID 46344114.
- ↑ a b Chen Y, Renfree MB (01/2020). "Hormonal and Molecular Regulation of Phallus Differentiation in a Marsupial Tammar Wallaby". secondary. Genes. 11 (1): 106. doi:10.3390/genes11010106. PMC 7017150. PMID 31963388.
- ↑ Turcu AF, Auchus RJ (Junio 2017). "Clinical significance of 11-oxygenated androgens". secondary. Curr Opin Endocrinol Diabetes Obes. 24 (3): 252–259. doi:10.1097/MED.0000000000000334. PMC 5819755. PMID 28234803.
- ↑ Asby DJ, Arlt W, Hanley NA (Marzo 2009). "The adrenal cortex and sexual differentiation during early human development". Rev Endocr Metab Disord. 10 (1): 43–9. doi:10.1007/s11154-008-9098-9. PMID 18670886. S2CID 20475488.
- ↑ Penning TM (Junio 1997). "Molecular endocrinology of hydroxysteroid dehydrogenases". secondary. Endocrine Reviews. 18 (3): 281–305. doi:10.1210/edrv.18.3.0302. PMID 9183566. S2CID 29607473.
- ↑ Schiffer L, Barnard L, Baranowski ES, Gilligan LC, Taylor AE, Arlt W, et al. (11/2019). "Human steroid biosynthesis, metabolism and excretion are differentially reflected by serum and urine steroid metabolomes: A comprehensive review". J Steroid Biochem Mol Biol. 194: 105439. doi:10.1016/j.jsbmb.2019.105439. PMC 6857441. PMID 31362062
- ↑ a b Penning TM, Wangtrakuldee P, Auchus RJ (Abril 2019). "Structural and Functional Biology of Aldo-Keto Reductase Steroid-Transforming Enzymes". Endocr Rev. 40 (2): 447–475. doi:10.1210/er.2018-00089. PMC 6405412. PMID 30137266.
- ↑ Baranowski ES, Arlt W, Idkowiak J (2018). "Monogenic Disorders of Adrenal Steroidogenesis". Horm Res Paediatr. 89 (5): 292–310. doi:10.1159/000488034. PMC 6067656. PMID 29874650.
- ↑ Schiffer L, Kempegowda P, Arlt W, O'Reilly MW (09/2017). "MECHANISMS IN ENDOCRINOLOGY: The sexually dimorphic role of androgens in human metabolic disease". Eur J Endocrinol. 177 (3): R125 – R143. doi:10.1530/EJE-17-0124. PMC 5510573. PMID 28566439.
- ↑ Eckstein B, Borut A, Cohen S (Abril 1987). "Metabolic pathways for androstanediol formation in immature rat testis microsomes". primary. Biochimica et Biophysica Acta (BBA) - General Subjects. 924 (1): 1–6. doi:10.1016/0304-4165(87)90063-8. PMID 3828389.
- ↑ Jeong HR (Junio 2022). "Commentary on "Classic and backdoor pathways of androgen biosynthesis in human sexual development"". Ann Pediatr Endocrinol Metab. 27 (2): 81–82. doi:10.6065/apem.2222057edi01. PMC 9260375. PMID 35793997.
- ↑ Balsamo A, Baronio F, Ortolano R, Menabo S, Baldazzi L, Di Natale V, et al. (2020). "Hiperplasias suprarrenales congénitas que se presentan en recién nacidos y bebés pequeños" . Pediatra frontal . 8 : 593315. doi : 10.3389/fped.2020.593315 . PMC 7783414. PMID 33415088 .
- ↑ "21-hydroxylase deficiency - About the Disease - Genetic and Rare Diseases Information Center". Archivado del original 30 Julio 2023. Consultado 13 Marzo 2024.
- ↑ Merke DP, Auchus RJ (2020). "Congenital Adrenal Hyperplasia Due to 21-Hydroxylase Deficiency". New England Journal of Medicine. 383 (13): 1248–1261. doi:10.1056/NEJMra1909786. PMID 32966723. S2CID 221884108. Archivado del original 12/10/2022. Consultado 13 Marzo 2024.
- ↑ Auchus RJ (2015). "The Classic and Nonclassic Concenital Adrenal Hyperplasias". Endocrine Practice. 21 (4): 383–389. doi:10.4158/EP14474.RA. PMID 25536973.
- ↑ van Rooyen D, Gent R, Barnard L, Swart AC (Abril 2018). "The in vitro metabolism of 11β-hydroxyprogesterone and 11-ketoprogesterone to 11-ketodihydrotestosterone in the backdoor pathway". primary. The Journal of Steroid Biochemistry and Molecular Biology. 178: 203–212. doi:10.1016/j.jsbmb.2017.12.014. PMID 29277707. S2CID 3700135.