Dióxido de bromo
| Dióxido de bromo | ||
|---|---|---|
| General | ||
| Fórmula estructural |
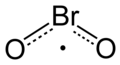 | |
| Fórmula molecular |
BrO 2 | |
| Identificadores | ||
| Número CAS | 21255-83-4[1] | |
| ChEBI | 29874 | |
| ChemSpider | 4574124 | |
| PubChem | 5460629 | |
|
O=Br=O
| ||
| Propiedades físicas | ||
| Masa molar | 111,903 g/mol | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
El dióxido de bromo es un compuesto binario formado por la unión de un átomo de bromo con dos de oxígeno y cuya fórmula es BrO2. Forma cristales inestables de color amarillo o amarillo anaranjado. Fue aislado por primera vez por R. Schwarz y M. Schmeißer en 1937 y se cree que es importante en la reacción atmosférica del bromo con el ozono.[2]
Reacciones
El dióxido de bromo se forma mediante descarga eléctrica cuando se una mezcla de gases de bromo y oxígeno, a baja temperatura y presión, por un tubo de descarga.[3]
El dióxido de bromo también se puede formar mediante el tratamiento del gas bromo con ozono en triclorofluormetano a -50 °C.
Cuando se mezcla con una base, el dióxido de bromo dismuta, reduciéndose a bromuro y oxidándose a bromato:[3]
Véase también
Referencias
- ↑ Número CAS
- ↑ Müller, Holger S. P.; Miller, Charles E.; Cohen, Edward A. (1997). «The rotational spectrum and molecular properties of bromine dioxide, OBrO». The Journal of Chemical Physics 107 (20): 8292. Bibcode:1997JChPh.107.8292M. ISSN 0021-9606. doi:10.1063/1.475030.
- ↑ a b Arora, M.G. (1997), P-Block Elements, New Delhi: Anmol Publications, p. 256, ISBN 978-81-7488-563-0, consultado el 17 March 2009.